فهرست عناوین
- مقدمه
- متانول: تعریف و ویژگی های اصلی
- اتانول: تعریف و ویژگی های اصلی
- تفاوت های ساختاری و ترکیب شیمیایی
- خواص فیزیکی: نقاط جوش، حلالیت و امتزاج پذیری
- روش های تولید متانول و اتانول
- محتوای انرژی و ویژگی های احتراق
- کاربردهای سوختی: متانول در برابر اتانول
- کاربردهای صنعتی و شیمیایی متانول و اتانول
- استفاده در محصولات مصرفی: از ضدیخ تا نوشیدنی ها
- سمیت و ایمنی: تأثیرات بر سلامت متانول و اتانول
- زمینه تاریخی و اکتشاف
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 22-07-1404
تاریخ بروزرسانی مقاله : 22-07-1404
تعداد کلمات : 3200
آدرس مقاله : لینک مقاله
متانول در مقایسه با اتانول ( تفاوت ها در تعریف و کاربرد )

مقدمه
متانول و اتانول دو الکل پرکاربرد هستند که ویژگی ها و کاربردهای متمایزی دارند. در نگاه اول، هر دوی آن ها به صورت مایع شفاف و قابل اشتعال دیده میشوند، اما هر کدام تفاوت های اساسی دارند در ساختار شیمیایی، ایمنی و کاربردها. متانول (الکل متیلیک) سادهترین الکل بوده و بسیار سمی است، در حالی که اتانول (الکل اتیلیک) دارای مولکولی کمی بزرگ تر است و همان نوع الکلی است که در نوشیدنی های الکلی یافت میشود. درک تفاوت های بین این دو الکل مهم است زیرا هر یک از آن ها رفتار متفاوت و کاربرد مخصوص به خود دارد. در این مقاله به بررسی تعاریف، ویژگی ها، روش های تولید و کاربردهای متانول و اتانول می پردازیم و نشان می دهیم که این دو الکل از چه نظر با هم تفاوت دارند و چرا این تفاوت ها مهم است.
متانول: تعریف و ویژگی های اصلی
متانول یک الکل ساده است که به نام الکل متیلیک یا الکل چوب نیز شناخته می شود. فرمول شیمیایی آن CH₃OH است و دارای یک اتم کربن متصل به یک گروه OH می باشد که این موضوع آن را ساده ترین عضو خانواده الکل ها می کند. متانول خالص مایعی بی رنگ، فرار و با بوی ملایم است. این ماده شدیداً اشتعال پذیر است و با شعله ای تقریباً نامرئی می سوزد. دلیل نام گذاری متانول به الکل چوب این است که زمانی از تقطیر تخریبی چوب تولید می شد. امروزه عمدتاً از گاز طبیعی یا زغال سنگ از طریق فرآیندهای صنعتی سنتز می شود. از نظر خواص، نقطه جوش متانول (حدود ۶۴٫۷ درجه سانتی گراد) پایین تر از اتانول است. همچنین از آب سبک تر است (چگالی حدود 0.79 گرم بر سانتی متر مکعب) و به طور کامل در آب و بسیاری از حلال های آلی حل می شود. یکی از ویژگی های مهم متانول سمی بودن آن است؛ حتی مقادیر کم آن برای انسان به شدت سمی بوده و در صورت مصرف می تواند باعث کوری یا مرگ شود. به دلیل سمی بودن، متانول در محصولات غذایی یا نوشیدنی به کار نمی رود. در عوض از آن به عنوان حلال صنعتی، عامل ضدیخ در مایع شیشه شوی خودرو، ماده اولیه برای تولید ترکیباتی مانند فرمالدهید، و همچنین در بخش های مختلف صنایع شیمیایی استفاده می شود. برای مصارف صنعتی، خرید متانول تهران گالن 20 لیتری گزینه ای رایج و اقتصادی به شمار می رود، زیرا حمل و نگهداری آن در این نوع بسته بندی آسان تر و ایمن تر است.
اتانول: تعریف و ویژگی های اصلی
اتانول یک الکل رایج است که به نام الکل اتیلیک یا الکل غلات نیز شناخته می شود. فرمول شیمیایی آن C₂H₅OH است که نشان دهنده ساختاری دو کربنه با یک گروه هیدروکسیل است. اتانول مایعی شفاف و بی رنگ با بوی ویژه الکل است (همان بوی آشنایی که در نوشیدنی های الکلی، عطرها و محلول های ضد عفونی دست احساس می شود). مانند متانول، اتانول نیز فرار و شدیداً اشتعال پذیر است و با شعله ای آبی که معمولاً قابل مشاهده است می سوزد. اتانول بیشتر به عنوان الکل موجود در نوشیدنی هایی مانند آبجو، شراب و مشروبات الکلی شناخته می شود و مصرف متعادل آن برای انسان بی خطر است. نقطه جوش آن (حدود ۷۸٫۳ درجه سانتی گراد) بالاتر از متانول بوده و چگالی آن در حدود 0.79 گرم بر سانتی متر مکعب است. به این ترتیب، فراریت آن نسبت به متانول اندکی کمتر است. اتانول عمدتاً از طریق تخمیر قندها توسط مخمر تولید می شود که معمولاً از موادی مانند ذرت، نیشکر یا سایر زیست توده ها به دست می آید. کاربردهای اتانول متنوع است: به عنوان حلال در داروسازی و لوازم آرایشی، ماده گندزدا و ضد عفونی کننده (مثلاً در محلول های ضد عفونی دست و دستمال های پزشکی) و یک افزودنی سوخت تجدیدپذیر مانند سوخت E10 یا E85 به کار می رود. در مقایسه با متانول، اتانول بسیار کم سمی تر است و به همین دلیل به طور گسترده در محصولاتی که با انسان در تماس هستند استفاده می شود.
تفاوت های ساختاری و ترکیب شیمیایی
از نظر شیمیایی، متانول و اتانول دارای گروه عاملی مشترکی هستند که معرف الکل ها است؛ یعنی گروه هیدروکسیل (-OH). اما ساختار مولکولی آن ها از نظر اندازه و ترکیب با یکدیگر تفاوت دارد. ساختار متانول از یک اتم کربن (CH₃OH) تشکیل شده و به همین دلیل ساده ترین مولکول الکل محسوب می شود. در مقابل، اتانول دارای دو اتم کربن (C₂H₅OH) است که یک گروه اتیل را تشکیل داده و به گروه هیدروکسیل متصل است. این اختلاف تنها یک اتم کربن شاید کوچک به نظر برسد، اما تأثیر قابل توجهی بر خواص فیزیکی و شیمیایی این دو الکل دارد. جرم مولکولی متانول حدود ۳۲ گرم بر مول است، در حالی که جرم مولکولی اتانول حدود ۴۶ گرم بر مول می باشد و این اختلاف به دلیل وجود یک اتم کربن اضافی و دو اتم هیدروژن بیشتر در اتانول است. زنجیر کربنی بلندتر در اتانول موجب می شود که این ماده نسبت به متانول کمی کمتر قطبی باشد، هرچند هر دو قادر به تشکیل پیوند هیدروژنی هستند. همچنین به دلیل ساختار بزرگ تر، اتانول نیروهای بین مولکولی قوی تری دارد و نقطه جوش آن بالاتر است. این تفاوت های ساختاری باعث بروز رفتارهای شیمیایی متفاوتی نیز می شوند؛ به عنوان نمونه در فرآیند سوخت و ساز بدن، متانول به دلیل ساختار ساده خود به ترکیباتی مانند فرمالدهید و اسید فرمیک تجزیه می شود که هر دو بسیار سمی هستند. به همین دلیل متانول خوراکی؟ (چرا متانول غیر قابل آشامیدن است) پرسشی اساسی در شیمی و ایمنی مواد محسوب می شود، زیرا حتی مقادیر بسیار کم از متانول می تواند منجر به کوری یا مرگ انسان شود، در حالی که اتانول در دوزهای محدود خوراکی قابل استفاده است و در بدن به استالدهید و سپس اسید استیک که کم خطرترند تبدیل می شود.
خواص فیزیکی: نقاط جوش، حلالیت و امتزاج پذیری
هر دوی متانول و اتانول بسیاری از ویژگی های فیزیکی مشترک بین الکل ها را دارند، اما تفاوت های قابل توجهی نیز در خواص آن ها دیده می شود. یکی از تفاوت های کلیدی نقطه جوش آن ها است: متانول خالص در حدود 64.7°C می جوشد، در حالی که اتانول در حدود 78.3°C می جوشد. این یعنی متانول فرارتر است و در یک دمای معین سریع تر از اتانول تبخیر می شود. در مورد انجماد، اتانول در حدود -114°C منجمد می شود، در حالی که متانول در حدود -97°C یخ می زند. یعنی اتانول می تواند در دماهای پایین تری نسبت به متانول مایع باقی بماند. از نظر چگالی، هر دو کمی از آب سبک تر هستند (~0.79 گرم بر سانتی متر مکعب) و متانول تنها اندکی چگال تر از اتانول است. هر دو الکل به طور کامل در آب مخلوط می شوند و متانول به ویژه جاذب رطوبت است و به راحتی رطوبت هوا را جذب می کند. هر دوی آن ها حلال های بسیار خوبی برای بسیاری از ترکیبات آلی نیز هستند. هر دو مایع بی رنگ و شفاف اند. بوی اتانول معمولاً قوی تر و مشهودتر است (مشابه بوی نوشیدنی های الکلی)، در حالی که بوی متانول ملایم تر است. هر دو ماده به شدت قابل اشتعال اند، اما نوع شعله آن ها کمی متفاوت است: متانول با شعله آبی کم رنگی می سوزد که تقریباً در روشنایی روز نامرئی است، در حالی که اتانول با شعله آبی واضح تری می سوزد. این ویژگی های فیزیکی متمایز بر نحوه برخورد با هر یک از این الکل ها و کاربرد آن ها در شرایط مختلف تأثیر می گذارد.
روش های تولید متانول و اتانول
متانول و اتانول از فرآیندهای کاملاً متفاوتی تولید می شوند که بازتاب دهنده خاستگاه های متمایز آن ها است. اتانول عمدتاً به صورت زیستی و از طریق تخمیر تولید می شود. در این فرآیند، مخمر یا سایر ریزسازواره ها با تغذیه از قندها (از منابعی مانند ذرت، نیشکر یا دیگر زیست توده ها) اتانول و دی اکسید کربن تولید می کنند. محلول رقیق اتانول حاصل از تخمیر سپس تقطیر می شود تا غلیظ گردد. به این ترتیب اتانول (در صورت استفاده از محصولات کشاورزی) یک منبع تجدیدپذیر به شمار می رود. اتانول همچنین می تواند به صورت مصنوعی از خوراک های نفتی (مثلاً با آب دار کردن اتیلن) تولید شود، هرچند این روش امروزه چندان رایج نیست. از سوی دیگر، تولید متانول عموماً یک فرآیند پتروشیمیایی است. امروزه متانول معمولاً از گاز سنتز (مخلوط مونوکسید کربن و هیدروژن) تولید می شود. گاز سنتز از ریفورمینگ با بخار گاز طبیعی یا گازی سازی زغال سنگ یا زیست توده به دست می آید. سپس در حضور کاتالیزگر، CO و H₂ موجود در گاز سنتز در فشار بالا واکنش داده و متانول حاصل می شود. بنابراین، تولید متانول در مقیاس بزرگ همچنان به سوخت های فسیلی متکی است، اگرچه روش های جدیدتری برای تولید متانول سبز از زیست توده یا حتی از CO₂ جذب شده (با استفاده از هیدروژن تجدیدپذیر) در دست بررسی است. در مجموع تولید اتانول ریشه در فرآیندهای زیستی دارد، در حالی که تولید متانول بر فرآیندهای صنعتی شیمیایی و منابع فسیلی متکی است.
محتوای انرژی و ویژگی های احتراق
به طور مشخص، اتانول حدود 24 مگاژول بر لیتر انرژی فراهم می کند، در حالی که متانول تقریباً 16 مگاژول بر لیتر (حدود یک سوم کمتر) انرژی دارد. بنابراین یک خودرویی که با متانول کار می کند با همان حجم سوخت، مسافت کوتاه تری را نسبت به خودرویی که با اتانول کار می کند طی خواهد کرد. با این حال، هر دو سوخت عدد اکتان بسیار بالایی دارند (معمولاً بالای 100). عدد اکتان متانول حتی اندکی بیشتر از اتانول است؛ یعنی هر دو می توانند موتورهای با تراکم بالا را بدون کوبش به کار اندازند. هر دو نسبت به بنزین تمیزتر می سوزند و دوده و برخی آلاینده های کمتری منتشر می کنند. احتراق ناقص می تواند محصولات سمی ایجاد کند: برای مثال، ممکن است متانول در دود خروجی فرمالدهید و اتانول استالدهید تولید کند. این ویژگی های سوخت بر موارد مصرف آن ها تأثیر گذاشته است: مثلاً متانول زمانی به عنوان سوخت موتور خودروهای مسابقه ای محبوب بود (به دلیل عدد اکتان بالا و اثر خنک کنندگی آن)، در حالی که اتانول اکنون به طور گسترده در ترکیبات سوخت معمول خودروها مانند سوخت E10 یا E85 به کار می رود. در نهایت انرژی بالاتر اتانول در برابر اکتان بالاتر متانول یک موازنه در ویژگی های عملکرد سوخت به شمار می رود.
کاربردهای سوختی: متانول در برابر اتانول
اتانول امروزه به عنوان یک سوخت تجدیدپذیر متداول مطرح است. در بسیاری از کشورها به بنزین افزوده می شود (برای مثال ۱۰٪ در بنزین معمولی یا تا ۸۵٪ در سوخت ویژه خودروهای انعطاف پذیر سوخت). در کشورهایی مانند برزیل، اتانول حاصل از نیشکر به عنوان سوخت اصلی خودرو استفاده می شود. اتانول به دلیل تجدیدپذیر بودن و امکان استفاده در موتورهای معمولی (به صورت مخلوط های معتدل) با تغییر کم، به عنوان یک سوخت زیستی محبوبیت یافته است. در مقابل, استفاده از متانول به عنوان سوخت بسیار محدودتر است. از این ماده در مسابقات اتومبیل رانی استفاده می شد (مثلاً خودروهای مسابقات ایندی به مدت چند دهه با متانول کار کردند) که به علت عدد اکتان بالا و خاصیت خنک کنندگی آن بود. اما برای خودروهای عادی, محتوای انرژی پایین, خورندگی و سمیت متانول مانع رواج گسترده آن شده است. برخی مناطق نیز مخلوط بنزین و متانول مانند سوخت M15 با ۱۵٪ متانول را آزمایش کردند، اما چنین سوخت هایی در جایگاه های سوخت رایج نشد. در عوض، متانول بیشتر به طور غیر مستقیم یا در کاربردهای خاص استفاده می شود: به عنوان مثال، یک ماده کلیدی در تولید بیودیزل است (برای واکنش با روغن های گیاهی به منظور تولید بیودیزل) و همچنین به عنوان یک سوخت پاک تر برای کشتی ها و مصارف صنعتی در حال بررسی است. در مجموع اتانول جایگاه خود را در بازار سوخت خودرو تثبیت کرده است، در حالی که نقش متانول به عنوان سوخت همچنان به کاربردهای تخصصی و چشم اندازهای آینده محدود مانده است.
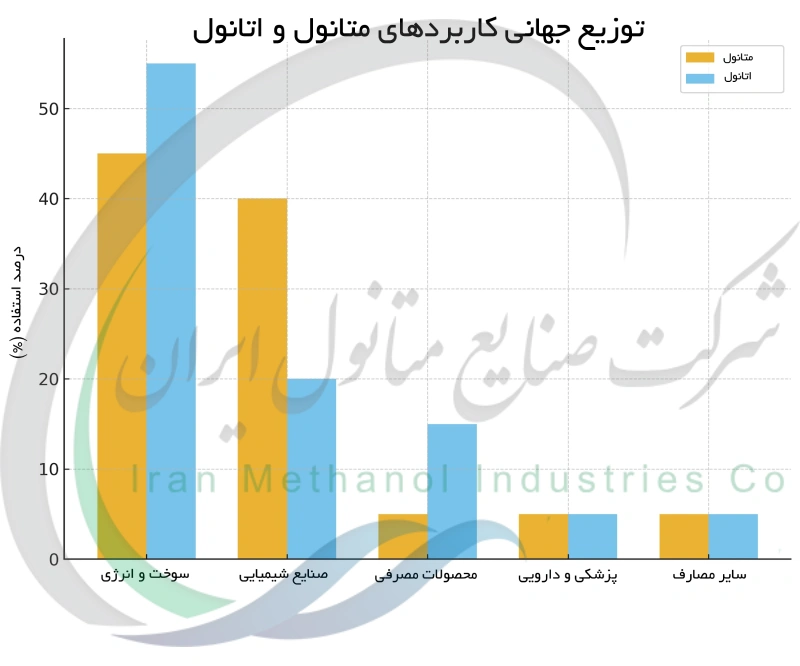
کاربردهای صنعتی و شیمیایی متانول و اتانول
فراتر از نقش آنها در سوخت، متانول و اتانول به عنوان مواد خام و حلالهای مهم در صنایع شیمیایی به کار میروند. متانول به ویژه ماده اولیه اصلی برای تولید سایر مواد شیمیایی است. بخش بزرگی از متانول تولیدی به فرمالدهید (جهت ساخت پلاستیک ها, رزین ها و چسب ها) یا اسید استیک تبدیل می شود. همچنین متانول برای تولید مشتقات دیگری مانند MTBE و انواع حلال ها و پلیمرها به کار می رود. در فرآیندهای شیمیایی متانول اغلب به عنوان حلال یا واکنش دهنده به کار می روند. با این حال، به دلیل سمی بودن، متانول معمولاً محدود به فرایندهای صنعتی بسته است و در محصولات مصرفی حضور ندارد. در مقابل، اتانول به طور گسترده به عنوان حلال و ماده واسط در کاربردهای صنعتی (و حتی مصرفی) به کار می رود. در صنعت شیمیایی، اتانول می تواند به استالدهید یا اسید استیک اکسید شده یا به اتیل استات (حلال رایج) تبدیل شود. همچنین می توان از اتانول برای تولید اتیلن (در فرآیندهای ساخت پلاستیک) استفاده کرد. نکته دیگر اینکه متانول اغلب برای غیر قابل نوشیدن کردن اتانول (دناتوره کردن) به کار می رود؛ به این صورت که مقدار کمی متانول به اتانول افزوده می شود تا مصرف آن ناممکن گردد. در مجموع، متانول به عنوان پایه صنایع شیمیایی سنگین محسوب می شود، در حالی که همه کاره بودن و ایمنی نسبی اتانول باعث شده است که هم به عنوان حلال صنعتی و هم در محصولات مصرفی مورد استفاده قرار گیرد.
استفاده در محصولات مصرفی: از ضدیخ تا نوشیدنی ها
اتانول در بسیاری از محصولات خوراکی و بهداشتی یافت می شود، در حالی که متانول به خاطر سمیت شدید خود فقط در کاربردهای فنی و صنعتی حضور دارد و هرگز به شکل عمدی به مواد غذایی یا نوشیدنی اضافه نمی شود. برای مثال، اتانول الکل موجود در نوشیدنی های الکلی (مانند آبجو، شراب و مشروبات) است که مردم مصرف می کنند. همچنین در بسیاری از محصولات خانگی و مراقبت شخصی استفاده می شود: عطرها و ادکلن ها از اتانول به عنوان حلال سریع التبخیر استفاده می کنند، دهان شویه ها و برخی شربت های دارویی حاوی اتانول هستند و ضد عفونی کننده های دست اغلب با اتانول فرموله می شوند. بسیاری از عصاره های طعم دهنده خوراکی (مانند عصاره وانیل) نیز با اتانول تهیه می شوند. در مقابل متانول به هیچ وجه در خوراک انسان به کار نمی رود زیرا حتی مقدار کمی از آن نیز می تواند سمی باشد. موارد مصرف متانول صرفاً در محصولات غیر خوراکی است: یک نمونه متداول آن مایع شیشه شوی خودرو است که معمولاً دارای متانول برای جلوگیری از یخ زدگی می باشد. ضدیخ های برخی رادیاتورها نیز حاوی متانول هستند و متانول به عنوان سوخت در اجاق های کمپینگ یا شعله های الکلی (سوخت های کنسروی) نیز استفاده می شود. هر محصول مصرفی که متانول در آن وجود داشته باشد معمولاً دارای هشدارهای سمی واضح هستند. در مجموع اتانول در طیف گسترده ای از محصولات روزمره که مصرف می کنیم یا روی پوست خود به کار می بریم حضور دارد، در حالی که استفاده از متانول تنها به موادی مانند ضد یخ و حلال های فنی (همراه با برچسب هشدار) محدود شده و هرگز در فرآورده های خوراکی وارد نمی شود.
سمیت و ایمنی: تأثیرات بر سلامت متانول و اتانول
تفاوت شدید در سمیت میان متانول و اتانول یکی از دلایل اصلی تفاوت موارد استفاده آن ها است. متانول برای انسان بسیار سمی است. مصرف حتی مقدار کمی (حدود ۱۰ میلی لیتر متانول خالص) می تواند باعث نابینایی دائمی شود و حدود ۳۰ میلی لیتر می تواند کشنده باشد. علت این است که متانول در کبد به فرمالدهید و اسید فرمیک تجزیه می شود که به عصب بینایی آسیب رسانده و اسیدوز متابولیک مرگبار ایجاد می کنند. علائم مسمومیت با متانول ممکن است شامل سر درد، سرگیجه، تهوع و تاری دید باشد و در صورت عدم درمان به کما و مرگ منجر گردد. درمان فوری پزشکی ضروری است جالب اینکه یکی از پادزهرهای مسمومیت متانول خود اتانول است (یا داروی فومپیزول) که با مسدود کردن سوخت و ساز متانول در بدن از تشکیل مواد سمی جلوگیری می کند. در مقابل اتانول با اینکه مست کننده و در صورت افراط مضر است به مراتب کم خطرتر است. اتانول همان الکل نوشیدنی ها است؛ مصرف متعادل آن معمولاً فقط باعث مستی موقت می شود و آسیبی درازمدت وارد نمی کند (در افراد سالم). البته دوزهای بسیار بالای اتانول نیز می تواند مرگبار باشد (مسمومیت الکلی) و مصرف طولانی مدت و سنگین آن ممکن است به کبد آسیب رسانده و اعتیاد و مشکلات سلامت ایجاد کند. به عنوان مقایسه، دوز مرگ اتانول بسیار بیشتر است معمولاً صدها میلی لیتر اتانول خالص لازم است تا مرگ رخ دهد، در حالی که برای متانول ده ها میلی لیتر کافی است. در زمینه کار با این مواد، متانول نیازمند احتیاطات بسیار شدیدتری است: هنگام کار باید حتما از دستکش، عینک و تهویه مناسب استفاده شود تا از تماس پوست و تنفس بخارات آن جلوگیری گردد. اتانول نیز بسیار آتشگیر است و باید در نزدیکی شعله با احتیاط به کار رود، اما تماس معمولی پوست یا تنفس مقدار کم بخارات اتانول (مثلاً هنگام استفاده از ضد عفونی کننده دست یا الکل آزمایشگاهی) عموماً کشنده نیست.
زمینه تاریخی و اکتشاف
اتانول هزاران سال است که توسط بشر شناخته شده و استفاده می شود، در حالی که کشف و کاربرد متانول بسیار دیرتر صورت گرفته است. انسان ها از دوران باستان به طور طبیعی با تخمیر اتانول تولید کرده و نوشیدنی های الکلی می ساختند. تقطیر اتانول به مشروبات قوی تر در قرون وسطا توسط کیمیاگران و دانشمندان (مثلاً در دوران طلایی اسلام و سپس در اروپا) انجام گرفت و عرق یا الکل به طور وسیع در دسترس قرار گرفت. در مقابل، متانول (الکل چوب) تا قرن هفدهم به صورت خالص جداسازی نشده بود. در سال ۱۶۶۱ شیمیدان ایرلندی رابرت بویل با تقطیر چوب یک روح چوب ناخالص به دست آورد که اشاره اولیه به متانول است. تا قرن نوزدهم، فرمول شیمیایی و خواص متانول به طور کامل تعیین نشد؛ در دهه ۱۸۳۰ شیمیدانان فرانسوی ژان-باپتیست دوما و اوژن پلیگو فرمول و ویژگی های متانول را شناسایی کرده و آن را الکل متیلیک نام گذاری کردند. تولید تجاری متانول تازه از قرن بیستم آغاز شد. در طی جنگ جهانی اول و پس از آن، متانول به مقدار کم با تقطیر چوب برای کاربردهای صنعتی به دست می آمد (از این رو نام الکل چوب رواج یافت). در دهه ۱۹۲۰، شیمیدانان یک روش سنتزی توسعه دادند تا متانول را از گاز سنتز مخلوط CO و H₂ تولید کنند که توسط شرکت BASF به تولید صنعتی متانول در مقیاس بزرگ منجر شد. سمی بودن متانول نیز در تاریخ بدنام است به عنوان مثال در دوره ممنوعیت الکل در آمریکا در دهه ۱۹۲۰، برخی افراد بر اثر مصرف مشروبات تقلبی حاوی متانول مسموم شده و دچار نابینایی یا مرگ شدند. امروزه اتانول همچنان الکل مورد استفاده در نوشیدنی ها است و هزاران سال است که بخشی از فرهنگ بشری محسوب می شود، در حالی که متانول عمدتاً با پیشرفت های علمی و صنعتی در تاریخ جدیدتر به عرصه کاربرد وارد شده است. جدول زیر مقایسهای کوتاه از تفاوتهای کلیدی متانول و اتانول در زمینه ویژگیهای شیمیایی، ایمنی، تولید و کاربردها ارائه میدهد.
| ویژگی | متانول (CH₃OH) | جزئیات متانول | اتانول (C₂H₅OH) | جزئیات اتانول |
|---|---|---|---|---|
| فرمول شیمیایی | CH₃OH | 1 اتم کربن (گروه متیل) | C₂H₅OH | 2 اتم کربن (گروه اتیل) |
| نقطه جوش | 64.7°C | پایینتر (فرارتر) | 78.3°C | بالاتر (کمفرارتر) |
| محتوای انرژی (حدوداً) | ~16 MJ/L | چگالی انرژی کمتر | ~24 MJ/L | چگالی انرژی بیشتر |
| سمیت | بسیار بالا | مصرف آن موجب کوری یا مرگ میشود | پایین | نوشیدن متعادل بیخطر (مستکننده) |
| متابولیتها در انسان | فرمالدهید و اسید فرمیک | بسیار سمی | استالدهید و اسید استیک | کمسمتر |
| روش تولید اصلی | از گاز سنتز (گاز طبیعی/زغال) | عمدتاً فسیلی | تخمیر زیستتوده | تجدیدپذیر (گیاهی) |
| کاربردهای معمول | حلال، ضدیخ، سوخت، ماده اولیه | در محصولات خوراکی استفاده نمیشود | نوشیدنیها، افزودنی سوخت، حلال، ضدعفونی | مصرف انسانی و صنعتی |




