فهرست عناوین
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 13-05-1404
تاریخ بروزرسانی مقاله : 13-05-1404
تعداد کلمات : 2300
آدرس مقاله : لینک مقاله
معرفی متانول و تعاریف اصلی

مقدمه
متانول ساده ترین الکل با فرمول شیمیایی CH3OH و یک ترکیب آلی پایه با یک اتم کربن است. این ماده مایعی بی رنگ ، فرار و شدیدا قابل اشتعال با بویی ملایم شبیه بوی الکل است. متانول که با نام هایی مانند متیل الکل یا الکل چوب نیز شناخته می شود ، در گذشته از تقطیر چوب تولید می شد و امروزه به صورت صنعتی از گاز سنتز تولید می شود. متانول کاربردهای متعددی به عنوان حلال ، سوخت و ماده اولیه برای تولید سایر مواد شیمیایی دارند ، اما در صورت بلعیده شدن برای انسان بسیار سمی است.
متانول چیست؟
متانول یک ترکیب الکلی است که از یک اتم کربن ، چهار اتم هیدروژن و یک اتم اکسیژن (CH3OH) تشکیل شده است. این ماده ساده ترین عضو خانواده الکل هاست ، بدین معنا که ساختار مولکولی آن شامل یک گروه متیل (CH3–) است که به یک گروه هیدروکسیل (–OH) متصل شده است. همین سادگی ، متانول را به یک مرجع پایه برای درک شیمی الکل ها تبدیل می کند. متانول خالص در شرایط استاندارد یک مایع شفاف است. بوی آن اندکی شیرین و شبیه اتانول است ، اما برخلاف همتای دو کربنه معروف خود ، متانول به هیچ وجه برای نوشیدن ایمن نیست. حتی دوزهای کوچک متانول می تواند به مسمومیت شدید منجر شود. اصطلاح الکل چوب از روش اولیه تهیه متانول گرفته شده است که طی آن چوب را در غیاب هوا حرارت می دادند (تقطیر تخریبی چوب) ، این فرایند به صورت تاریخی پیش از آغاز تولید مصنوعی مدرن به کار می رفت. درک دقیق خواص فیزیکی و شیمیایی متانول اهمیت ویژه ای دارد، زیرا شناخت این ویژگی ها از جمله نقطه جوش، چگالی، قطبیت، قابلیت اشتعال، سمیت و واکنش پذیری نقش اساسی در استفاده ایمن و کارآمد از این ماده در صنایع مختلف ایفا می کند و امکان ارزیابی کاربردهای آن در سوخت ها، حلال ها و سنتز مواد شیمیایی را فراهم می سازد.
ساختار شیمیایی و فرمول متانول
به لحاظ شیمیایی ، فرمول متانول CH3OH است که نشان می دهد در هر مولکول یک اتم کربن (C) ، چهار اتم هیدروژن (H) و یک اتم اکسیژن (O) وجود دارد. ساختار آن را می توان به صورت یک مولکول متان (CH4) در نظر گرفت که یک اتم هیدروژن آن با یک گروه هیدروکسیل (-OH) جایگزین شده است. این امر به متانول خاصیت قطبی می دهد زیرا گروه -OH قطبی است و تشکیل پیوند هیدروژنی را امکان پذیر می کند. وزن مولکولی متانول حدود 32.04 گرم بر مول است، که نشان می دهد این مولکول نسبتا سبک است. از نظر ساختاری ، اتم کربن در متانول دارای هیبریداسیون sp3 است و به صورت چهار وجهی به سه اتم هیدروژن و یک اتم اکسیژن (از گروه هیدروکسیل) پیوند یافته است. این ساختار ساده اغلب به صورت CH3–OH نمایش داده می شود. به دلیل اندازه کوچک و گروه هیدروکسیل قطبی ، متانول به طور کامل در آب و بسیاری از حلال های آلی قابل امتزاج است. ساختار متانول به عنوان ساده ترین الکل آلیفاتیک ، مبنایی برای مقایسه آن با الکل های بزرگ تر مانند اتانول و پروپانول فراهم می کند که کربن های بیشتری دارند اما گروه های عاملی مشابهی دارند.
خواص فیزیکی و شیمیایی متانول
متانول دارای خواص فیزیکی و شیمیایی متمایزی است که این ماده را در عین مفید بودن ، می تواند خطرناک نیز باشد. در دمای اتاق به حالت مایع است و نقطه جوش آن حدود 64.7 درجه سانتی گراد و نقطه انجماد (ذوب) آن در حدود -97.6°C می باشد. چگالی متانول در 20°C حدود 0.79 گرم بر سانتی متر مکعب است ، بدین معنی که از آب سبک تر است. به عنوان یک ترکیب آلی بسیار فرار ، متانول هنگام قرارگیری در معرض هوا به سرعت تبخیر می شود. نقطه اشتعال متانول تقریبا 12°C است ، یعنی در دماهای نسبتا پایین ، بخار قابل اشتعال تولید می کند. متانول به راحتی در هوا می سوزد و دی اکسید کربن و آب تولید می کند و شعله آن در روشنایی روز تقریبا نامرئی است (با رنگ آبی کم رنگ می سوزد). نقطه جوش متانول در مقایسه با آب پایین هستند که نشان دهنده ضعیف بودن نیروهای بین مولکولی در این مولکول کوچک است. از نظر شیمیایی ، متانول یک حلال پروتیک قطبی است که می تواند بسیاری از مواد را در خود حل کند. این ماده با آب در هر نسبتی مخلوط می شود و با اغلب حلال های آلی مانند استون ، اتر و هیدروکربن ها نیز قابل امتزاج است. یکی از ویژگی های شیمیایی قابل توجه متانول آن است که جاذب رطوبت (هیدروسکوپیک) بوده و بخار آب را از هوا جذب می کند. از نظر واکنش پذیری ، متانول می تواند طی اکسیداسیون به فرمالدهید و اسید فرمیک تبدیل شود و در ترکیب با هوا در غلظت های حدود 6% تا 36% حجمی مخلوط های انفجاری تشکیل می دهد. این خصوصیات نشان می دهد چرا متانول در صنعت ارزشمند است اما نیاز به احتیاط و مدیریت دارد.
تاریخچه متانول
سابقه متانول به چندین قرن پیش بازمی گردد. مصریان باستان به طور ناخواسته در فرایند مومیایی کردن با تجزیه حرارتی چوب (پیرولیز) متانول تولید می کردند. نخستین جداسازی متانول خالص در سال 1661 توسط رابرت بویل شیمیدان ایرلندی انجام شد ، او با تقطیر چوب شمشاد این ماده را استخراج کرد و آن را روح چوب نامید. برای مدت طولانی متانول تنها به عنوان محصول جانبی تقطیر چوب در دسترس بود و از این رو به آن الکل چوب می گفتند. در سال 1834 شیمیدان های فرانسوی ژان - باپتیست دوما و اوژن پلیگو ترکیب عنصری متانول را تعیین کردند و اصطلاح متیل (برگرفته از ریشه یونانی به معنی شراب + چوب) را برای رادیکال مشتق از روح چوب ابداع کردند. خود واژه متانول نیز در سال 1892 به عنوان نام پذیرفته شده برای متیل الکل معرفی شد. اولین تولید مصنوعی متانول (نه از چوب) در اوایل قرن بیستم تحقق یافت. در سال 1905 پل ساباتیه شیمیدان فرانسوی نشان داد که می توان با واکنش دادن دی اکسید کربن با هیدروژن ، متانول تولید کرد. در دهه 1920 تولید صنعتی متانول جنبه عملی پیدا کرد ، شیمیدانان شرکت BASF در آلمان یک فرایند کاتالیستی پرفشار برای تبدیل گاز سنتز (مخلوط مونوکسید کربن ، دی اکسید کربن و هیدروژن) به متانول توسعه دادند. تا سال 1923 کارخانه ای در آلمان با استفاده از کاتالیزورهای اکسید فلزی و در دما و فشار بالا مشغول تولید متانول بود. با گذشت زمان بهبودهایی نظیر استفاده از کاتالیزورهای پایه مس در دهه 1960 امکان داد متانول در فشارهای پایین تر و با کارایی بیشتر تولید شود. نقش متانول در طی جنگ جهانی دوم گسترش یافت زیرا در برخی سوخت های خاص استفاده شد. همچنین در بحران های نفتی دهه 1970 توجه ها به متانول به عنوان یک سوخت جایگزین جلب گردید. این تاریخ پربار از الکل چوب تا یک ماده پتروشیمیایی در مقیاس بزرگ ، اهمیت در حال تکامل متانول را برجسته می کند.
تولید متانول (روش های صنعتی)
تولید صنعتی مدرن متانول عمدتا به سنتز شیمیایی از خوراک های کربنی ساده متکی است. فرایند اصلی از گاز سنتز (سینگاز) استفاده می کند که مخلوطی از مونوکسید کربن (CO)، دی اکسید کربن (CO2) و هیدروژن (H2) است. گاز سنتز را می توان از گاز طبیعی (با رفرمینگ متان با بخار) ، از زغال سنگ (با گازی سازی) یا از زیست توده به دست آورد. در رایج ترین روش گاز طبیعی (متان) در حضور کاتالیزور با بخار آب واکنش داده می شود تا هیدروژن و مونوکسید کربن تولید گردد که سپس در یک راکتور به متانول تبدیل می شوند. واکنش نمونه: CO + 2 H2 → CH3OH که با استفاده از یک کاتالیزور (معمولا اکسید مس-روی روی آلومینا) در دمای حدود 250°C و فشار 50–100 اتمسفر انجام می شود. این فرآیند هیدروژناسیون کاتالیستی ، متانول را با گزینش پذیری بیش از 99% تولید می کند.
کاربردهای متانول در صنعت
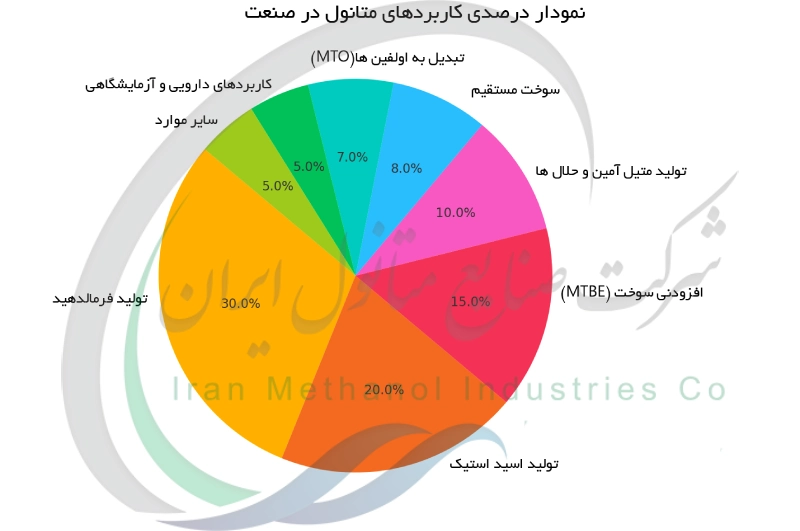
متانول به دلیل چند منظوره بودن کاربردهای گسترده ای در صنایع مختلف دارد. عمده ترین مصرف خرید متانول به عنوان خوراک تولید سایر مواد شیمیایی است. بخش بزرگی از متانول صنعتی برای ساخت فرمالدهید استفاده می شود که در رزین ها ، پلاستیک ها و چسب ها کاربرد دارد. اسید استیک و متیل ترت بوتیل اتر (MTBE) نیز از مشتقات مهم متانول هستند. متانول همچنین در تولید موادی نظیر متیل متاکریلات (برای پلاستیک های آکریلیک) ، متیلآمین ها و کلرومتان ها به کار می رود. در صنعت داروسازی از متانول به عنوان حلال یا ماده اولیه جهت سنتز داروها استفاده می شود. در حوزه انرژی ، متانول عنصری کلیدی برای تولید سوخت های پاک نظیر دی متیل اتر (جایگزین دیزل) است و در ساخت بیودیزل نیز نقش دارد. قدرت بالای حلالیت متانول باعث شده در پاککننده ها ، جوهرها و صنایع آزمایشگاهی کاربرد گسترده ای داشته باشد. متانول یک ماده حدواسط حیاتی و پلتفرمی برای تولید محصولات شیمیایی گوناگون محسوب می شود. نمودار پایین توزیع درصدی کاربردهای متانول در صنایع مختلف را نشان می دهد.
ایمنی و نحوه کار با متانول
با توجه به اشتعال پذیری و سمیت بالای متانول هنگام کار با این ماده باید اقدامات ایمنی دقیقی رعایت شود. متانول را باید در ظروف کاملا دربسته و در مکانی خنک ، دارای تهویه مناسب و دور از منابع اشتعال نگهداری کرد. بخارات متانول سنگین تر از هوا هستند و در محل های پایین تجمع می کنند که خطر آتش سوزی را افزایش می دهد. شعله متانول تقریبا نامرئی است و تشخیص آن دشوار است ، بنابراین وجود آشکارسازهای ویژه شعله ضروری است. افراد هنگام کار با متانول باید از دستکش ، عینک ایمنی یا شیلد صورت استفاده کنند. تهویه مناسب ، ماسک تنفسی و خاموشکننده های مخصوص متانول نیز الزامی است. ظروف باید برچسب واضح داشته و دور از دسترس کودکان باشند.
مقایسه متانول و اتانول : تفاوت های کلیدی
متانول و اتانول دو الکل ساده هستند که در ساختار ، سمیت و کاربرد تفاوت های مهمی دارند. متانول (CH₃OH) فقط یک اتم کربن دارد، در حالی که اتانول (C₂H₅OH) دارای دو اتم کربن است. نقطه جوش متانول (64.7°C) پایین تر و فراریت آن بیشتر است. هر دو بی رنگ بوده و بوی مشابه دارند ، اما متانول به شدت سمی است و مصرف آن خطرناک است در حالی که اتانول الکل نوشیدنی بوده و بدن انسان قادر به متابولیزه کردن آن است. شعله متانول تقریبا نامرئی است در حالی که شعله اتانول آبی و قابل مشاهده است. متانول از گاز سنتز تولید میشود ولی اتانول معمولا از تخمیر زیستی مواد قندی تهیه می گردد. انرژی تولید شده توسط اتانول نیز بیشتر از متانول است. جدول زیر برخی تفاوت های کلیدی بین متانول و اتانول را خلاصه می کند:
| جنبه | متانول (CH3OH) | اتانول (C2H5OH) | تفاوت کلیدی | ملاحظات |
|---|---|---|---|---|
| ساختار مولکولی | یک اتم کربن (گروه متیل + OH) | دو اتم کربن (گروه اتیل + OH) | متانول ساختار سادهتر و کوچکتری دارد. | منجر به تفاوت در خواص (مثلاً نقطه جوش و قطبیت) |
| نقطه جوش | 64.7 °C | 78.3 °C | نقطه جوش متانول پایینتر است. | متانول فرّارتر است و سریعتر تبخیر میشود. |
| محتوای انرژی | ~16 MJ در لیتر (ارزش حرارتی خالص) | ~21 MJ در لیتر (ارزش حرارتی خالص) | اتانول محتوای انرژی بیشتری دارد. | برای انرژی مساوی، حجم متانول بیشتری لازم است. |
| سمّیت | بسیار سمی؛ حدود 10 میلیلیتر میتواند کوری یا مرگ ایجاد کند. | مستیآور (در نوشیدنیها) اما در مقادیر کم کشنده نیست. | سرنوشت متابولیک کاملاً متفاوت در بدن. | متانول را نمیتوان مصرف کرد، اتانول در حد اعتدال قابل نوشیدن است. |
| قابلیت رؤیت شعله | شعله آبی کمرنگ و تقریباً نامرئی (به ویژه در روز) | شعله آبی که تا حدی قابل مشاهده است | شعله متانول کمنورتر (دوده کمتر) است. | آتش متانول دشوارتر تشخیص داده میشود (چالش ایمنی) |
| کاربردهای رایج | حلال صنعتی؛ خوراک تولید فرمالدهید، اسید استیک و غیره؛ سوخت موتورهای خاص | الکل آشامیدنی؛ حلال؛ افزودنی سوخت (بنزین E10/E85) | اتانول در نوشیدنیها و سوخت مصرف میشود، متانول صرفاً صنعتی است. | نشاندهنده تفاوتهای ایمنی و روشهای تولید است. |
| روشهای تولید | سنتز از گاز سنتز (CO + H2) با کاتالیزور (از گاز طبیعی، زغال سنگ، زیستتوده) | تولید از تخمیر قندها یا آبدهی اتیلن (نفت خام) | متانول معمولاً پتروشیمیایی/فسیلی، اتانول غالباً زیستی است. | بر پایداری و نوع خوراک مصرفی اثرگذار است. |
| فرمول شیمیایی | CH3OH (جرم مولی ~32) | C2H5OH (جرم مولی ~46) | متانول یک اتم کربن کمتر و سبکتر است. | بر رفتار فیزیکی و شیمیایی (قطبیت، امتزاجپذیری) اثر دارد. |
آینده متانول و متانول تجدیدپذیر (اقتصاد متانول)
چشم انداز آینده متانول بیش از پیش با انرژی پایدار و مفهوم اقتصاد متانول گره خورده است. این ایده که توسط دانشمندانی مانند جورج اولاه مطرح شده پیشنهاد می کند متانول به عنوان یک حامل انرژی تجدیدپذیر و چند منظوره می تواند جایگزین سوخت های فسیلی شود. یکی از دلایل اصلی این است که متانول را می توان از دی اکسید کربن و هیدروژن تولید کرد و بدین ترتیب انرژی برق تجدیدپذیر را در قالب مایع ذخیره نمود. هنگامی که منابع تجدیدپذیر (مانند خورشیدی یا بادی) برق تولید می کنند ، می توان آن برق را صرف الکترولیز آب برای تولید هیدروژن کرد و سپس هیدروژن را با CO2 جذب شده ترکیب کرد تا متانول ساخته شود. این متانول سبز یک سوخت کربن خنثی خواهد بود ، زیرا سوزاندن آن فقط همان CO2 ی را آزاد می کند که در ابتدا از اتمسفر گرفته شده بود. در حال حاضر علاقه به متانول سبز رو به افزایش است : شرکت ها در پروژه هایی برای تولید متانول از زیست توده یا حتی مستقیما از CO2 اتمسفری و هیدروژن سبز سرمایه گذاری می کنند. در صنعت حمل و نقل دریایی نیز چند شرکت بزرگ برنامه دارند کشتی هایی با سوخت متانول بسازند یا از متانول سبز برای کاهش انتشار آلاینده ها استفاده کنند. پیل های سوختی متانول نیز می توانند در کاربردهای خاص حمل و نقل یا توان قابل حمل ظهور کنند و جایگزینی پاک تر برای مولدهای بنزینی فراهم آورند. علاوه بر کاربردهای انرژی ، متانول به عنوان یک بلوک سازنده برای مواد شیمیایی سبز نیز در نظر گرفته می شود. به عنوان مثال از متانول تجدیدپذیر می توان برای ساخت پلاستیک ها یا سایر مواد با ردپای کربن کمتر بهره گرفت. از جمله چالش های تحقق اقتصاد متانول می توان به افزایش مقیاس تولید متانول تجدیدپذیر به صورت اقتصادی ، ایجاد زیرساخت های لازم برای توزیع و سوخت رسانی متانول و توجه به مسائل ایمنی (سمیت و اشتعال پذیری) در استفاده گسترده اشاره کرد. با این حال بسیاری از کشورها و صنایع به طور فعال در حال پژوهش و آزمایش راهکارهای مبتنی بر متانول هستند. به عنوان نمونه چین تعداد زیادی خودرو و اتوبوس متانول سوز را معرفی کرده و اروپا در حال تامین مالی احداث کارخانجات تولید متانول سبز است. با تشدید تلاش ها برای یافتن سوخت های پاک تر به دلیل تغییرات اقلیمی ، ترکیب ویژگی های متانول سادگی شیمیایی ، امکان ذخیره سازی به صورت مایع و کاربردهای متنوع ، آن را به گزینه ای امید بخش تبدیل کرده است.





بررسی ویژگی های فیزیکی و شیمیایی متانول و کاربردهای آن
آشنایی با اهمیت متانول در صنعت و زندگی و کاربردهای آن
آشنایی با دسته بندی متانول از نظر گرید و کاربرد و نحوه نگهداری و کاربری در همه گرید ها
بررسی واژه نامه متانول(اصلاحات و تعاریف مرتبط) و کاربردهای شیمیایی