فهرست عناوین
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 14-05-1404
تاریخ بروزرسانی مقاله : 14-05-1404
تعداد کلمات : 2500
آدرس مقاله : لینک مقاله
متانول چیست؟

مقدمه
متانول یک ترکیب الکلی ساده با فرمول شیمیایی CH3OH است. این ماده کوچک ترین و ساده ترین عضو خانواده الکل ها به شمار می رود و اغلب از آن با نام الکل متیلیک یا الکل چوب یاد می شود. متانول مایعی بی رنگ و قابل اشتعال است که بویی شبیه به بوی اتانول (الکل نوشیدنی) دارد. با این حال برخلاف اتانول قابل آشامیدن ، متانول برای انسان بسیار سمی است. به دلیل اینکه در گذشته از تقطیر چوب به دست می آمد به آن لقب روح چوب نیز داده بودند. امروزه متانول یک ماده شیمیایی صنعتی مهم و یک منبع انرژی نوظهور است که از تولید پلاستیک ها گرفته تا سوخت رسانی به خودروها کاربرد دارد.
متانول : تعریف و هویت شیمیایی
متانول به عنوان یک ترکیب شیمیایی آلی در رده الکل ها تعریف می شود. این ماده از یک اتم کربن متصل به سه اتم هیدروژن و یک گروه هیدروکسیل تشکیل شده اند و سادهترین الکل آلیفاتیک محسوب می شود. متانول خالص به صورت مایعی شفاف و سبک تر از آب دیده می شود. این ترکیب با نام های گوناگونی شناخته می شود از جمله متیل الکل و کاربینول اما نام متانول از اواخر قرن نوزدهم به صورت رسمی برای آن پذیرفته شد. به عنوان ساده ترین الکل ، متانول یک سنگ بنای بنیادی در شیمی آلی و صنایع به شمار می آید.
ویژگی های فیزیکی و شیمیایی متانول
متانول دارای ویژگی های فیزیکی و شیمیایی منحصربه فردی است. این ماده در دمای اتاق یک مایع سبک و فرار است و نقطه جوش آن حدود ۶۴٫۷ درجه سلسیوس و نقطه انجمادش حدود منفی ۹۷٫۶ درجه سلسیوس می باشد. متانول به راحتی با آب ترکیب می شوند و به خاطر اندازه کوچک مولکول و گروه هیدروکسیل قطبی خود با بسیاری از حلال های آلی نیز امتزاج پذیر است. این الکل به آسانی در هوا می سوزد و شعله ای آبی کم رنگ تولید می کند که در روشنایی روز تقریبا نامرئی است. به عنوان سوخت ، متانول عدد اکتان بالایی دارد اما از نظر محتوی انرژی حجمی تقریبا نصف بنزین انرژی فراهم می کند. از دید شیمیایی ، متانول یک الکل است و واکنش های تیپیک الکل ها را نشان می دهد. به عنوان مثال می تواند به آسانی اکسید شده و به فرمالدهید یا اسید فرمیک تبدیل شود. بخارات و مایع متانول بسیار آتشگیر هستند و در غلظت های معینی با هوا مخلوط های انفجاری تشکیل می دهند. به طور کلی ترکیب نقطه جوش پایین ، امتزاج کامل با آب و اشتعال پذیری بالا باعث شده است متانول به عنوان حلال و سوختی منحصر به فرد مطرح باشد.
تاریخچه کشف متانول
تاریخچه کشف متانول به چند قرن پیش بازمی گردد. مصریان باستان در فرآیند مومیایی کردن به طور ناخواسته مقادیر کمی متانول تولید می کردند ، چرا که در طی پیرولیز چوب جهت تهیه رزین های تدفینی ، متانول به عنوان یکی از محصولات جانبی آزاد می شد. متانول خالص برای اولین بار در سال ۱۶۶۱ توسط شیمیدان ایرلندی رابرت بویل از طریق تقطیر چوب (چوب جعبه) جدا شدند. برای مدت ها این ماده جدید با نام روح چوب یا نفتای چوب شناخته می شد که منعکس کننده منشاء آن از حرارت دهی چوب بود. در دهه ۱۸۳۰ میلادی شیمیدان های فرانسوی ژان-باتیست دوما و اوگوست پلیگوت ترکیب عنصری متانول را تعیین کردند و واژه متیلن (از واژه یونانی به معنای شراب + چوب) را معرفی کردند که پایه ای برای نام گذاری متیل شد. خود واژه متانول رسما در سال ۱۸۹۲ پذیرفته شد که از کلمه متیل الکل گرفته شده بود. در اوایل قرن بیستم دانشمندان روش هایی برای سنتز متانول بدون نیاز به چوب کشف کردند : در سال ۱۹۲۳ اولین فرآیند صنعتی برای تولید متانول از گاز سنتز (مخلوط هیدروژن و مونوکسید کربن) در آلمان توسعه یافت. طی جنگ جهانی دوم متانول به عنوان جزء سوخت برخی راکت ها و موتورهای آلمانی به کار رفت. به مرور زمان روش های تولید بهبود یافتند و متانول به یک ماده شیمیایی کالا در مقیاس جهانی تبدیل شد.
حضور طبیعی متانول
متانول تنها یک ماده تولید شده توسط انسان نیست ، بلکه به طور طبیعی نیز در محیط یافت می شود. مقادیر اندکی از متانول توسط موجودات زنده تولید می گردد. برای مثال میوه ها و سبزیجات هنگام رسیدن مقادیر ناچیزی متانول آزاد می کنند که ناشی از تجزیه پکتین در بافت گیاهی است. حتی در بدن انسان نیز میزان بسیار کمی متانول به طور طبیعی وجود دارد. به عنوان نمونه در تنفس یک فرد سالم چند قسمت در میلیون بخار متانول مشاهده می شود که حاصل فرآیندهای متابولیکی طبیعی است. متانول به طرق دیگری نیز در دنیای طبیعی دیده می شود : برخی باکتری ها و فیتوپلانکتون ها در طی تجزیه مواد آلی متانول تولید می کنند. در اتمسفر نیز متانول یکی از بسیاری ترکیبات آلی فرار است که با غلظت های اندک حضور دارد. جالب اینجاست که ستاره شناسان ابرهای عظیمی از متانول را در فضا و در نواحی ستاره ساز شناسایی کرده اند. این حضورهای طبیعی نشان می دهد که متانول یک ماده فراگیر (هرچند در غلظت های بسیار ناچیز) در محیط ماست.
تولید صنعتی متانول
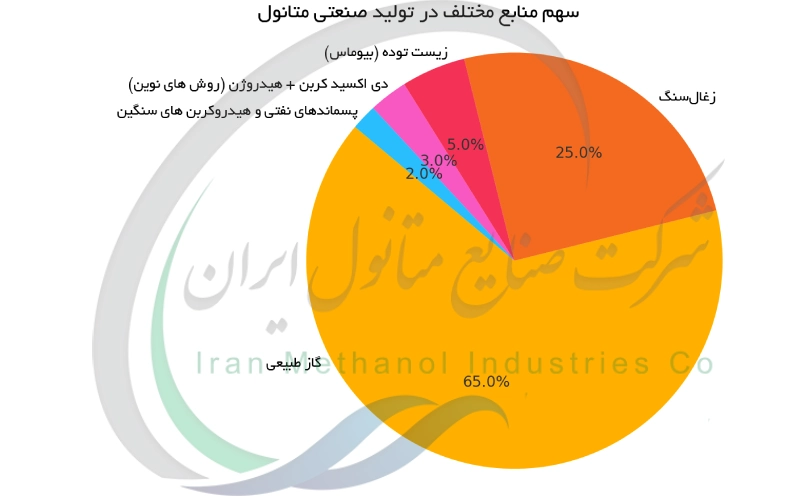
امروزه تولید صنعتی متانول عمدتا از طریق سنتز شیمیایی و استفاده از گاز سنتز انجام می شود. گاز سنتز که مخلوطی از مونوکسید کربن (CO) و هیدروژن (H2) است ، اغلب از گاز طبیعی به دست می آید. در این فرآیند گاز طبیعی ابتدا با بخار آب ریفرم می شود تا گاز سنتز تولید شود ، سپس این گاز در حضور کاتالیزور (عموما بر پایه مس) ، تحت فشار و دمای بالا به متانول تبدیل می شود. سایر خوراک ها مثل زغال سنگ ، پسماندهای نفتی ، زیست توده (پسماندهای کشاورزی ، چوب ، زباله های شهری) و حتی دی اکسید کربن نیز می توانند برای تولید گاز سنتز استفاده شوند. امروزه تولید جهانی متانول بیش از ۱۰۰ میلیون تن در سال است و عمدتا در آسیا ، خاورمیانه و آمریکا صورت می گیرد.
کاربردهای متانول
خرید متانول کاوه از شرکت صنایع متانول ایران انجام می گیرد که یک ماده بسیار چندکاره است و دامنه وسیعی از کاربردها را در صنایع مختلف دارد. از استفاده به عنوان ماده خام در تولید شیمیایی گرفته تا نقش آفرینی به عنوان سوختی پاک ، متانول کاربردهای متنوعی دارد. در صنایع شیمیایی متانول یک خوراک حیاتی برای تولید بسیاری مواد شیمیایی و مواد اولیه صنعتی مهم است. در زندگی روزمره ما بسیاری از محصولات ، پیدایش خود را مدیون ترکیبات مشتق شده از متانول هستند. از قطعات پلاستیکی لوازم خانگی گرفته تا رنگی که دیوارهایمان را پوشانده است. متانول همچنین به عنوان حلال و ضدیخ در کاربردهای گوناگون استفاده می شود. در بخش انرژی ، متانول به عنوان یک سوخت جایگزین برای خودروها و کشتی ها و حتی به عنوان حامل انرژی در پیل های سوختی مورد توجه قرار گرفته است. در زیر جدولی آورده شده است که برخی از کاربردهای عمده متانول و دلیل اهمیت آنها را نمایش می دهد:
| کاربرد | توضیحات | محصولات/موارد استفاده | اهمیت | نکات |
|---|---|---|---|---|
| تولید فرمالدهید | اکسیداسیون متانول (معمولاً با کاتالیزور) برای تولید فرمالدهید گازی | رزینها و پلاستیکها (مانند چسبها، رزین تخته چندلا، پلاستیکها) | بزرگترین مصرف متانول در جهان (حدود ۳۰٪ تقاضا) | برای مواد ساختمانی حیاتی است؛ خود فرمالدهید سمی بوده و تحت مقررات ایمنی قرار دارد |
| تولید اسید استیک | کربونیلاسیون متانول (واکنش با CO) برای تولید اسید استیک | مشتقات اسید استیک (مانند وینیل استات برای رنگها، الیاف و برخی پلیمرها) | از مصارف عمده متانول (جزو ۲-۳ کاربرد برتر) | حیاتی برای تولید پلاستیکها و حلالها؛ پایه تولید پلیاسترها و فیلمهای پلیمری مدرن |
| MTBE (افزودنی سوخت) | ترکیب متانول با ایزوبوتیلن جهت تولید متیل ترشری بوتیل اتر (MTBE) | جزء اکتانافزای بنزین (افزودنی به بنزین) | به طور گسترده به عنوان اکسیژندهنده بنزین استفاده شده (خصوصاً در دهههای گذشته) | کارایی موتور را بهبود میدهد؛ در برخی مناطق به دلیل مشکلات آلودگی آب کنار گذاشته شده است |
| تبدیل متانول به الفینها (MTO) | تبدیل متانول به اتیلن و پروپیلن با استفاده از کاتالیزورهای ویژه | تولید الفینها برای پلاستیکها (اتیلن و پروپیلن → پلیاتیلن، پلیپروپیلن و غیره) | کاربرد در حال رشد سریع (به ویژه در چین) | مسیر جایگزین برای تولید پلاستیک از زغالسنگ یا گاز طبیعی به جای نفت خام فراهم میکند |
| سوخت برای وسایل نقلیه | استفاده به عنوان سوخت به صورت خالص یا مخلوط با بنزین (مثل M15، M85) | سوخت خودرو (خودروهای سواری، کامیونها، خودروهای مسابقه) | مصرف محدود ولی روبهرشد به عنوان سوخت جایگزین | عدد اکتان بالا و احتراق پاک؛ چگالی انرژی پایینتر نیازمند اصلاح موتور است |
| حلال و ضدیخ | استفاده به عنوان حلال صنعتی و ماده ضدیخ در محصولات | حلال صنعتی؛ مایع شیشهشور خودرو؛ ضدیخ خطوط لوله | مصرف متوسط در صنایع و محصولات مختلف | در کاهش نقطه انجماد مؤثر است؛ در صورت نوشیدن سمی است (در برخی کشورها ممنوع شده) |
| افزودنی غیر قابل شرب کردن اتانول (دناتورانت) | افزودن متانول به اتانول در مقادیر کم برای غیرقابل نوشیدن کردن آن (الکل صنعتی) | الکل دناتوره برای مصارف صنعتی و خانگی (تمیزکنندهها، سوخت) | عملی رایج در سراسر جهان (سهم کمی از مصرف متانول) | از سوءمصرف اتانول صنعتی جلوگیری میکند؛ معمولاً رنگی و با طعم/بوی نامطبوع است |
| تولید بیودیزل | واکنش متانول با روغنهای گیاهی یا چربیها (ترانساستریفیکاسیون) برای تولید استرهای متیل اسیدهای چرب | سوخت بیودیزل (جایگزین تجدیدپذیر گازوئیل) | مهم برای صنعت سوختهای زیستی (هر محموله بیودیزل ~۱۰٪ وزنی متانول مصرف میکند) | امکان تولید سوخت دیزل تجدیدپذیر؛ اکثر واحدهای بیودیزل به متانول وابستهاند |
متانول به عنوان خوراک صنعتی
اهمیت متانول در صنعت و زندگی به عنوان خوراک در صنایع شیمیایی است. بخش قابل توجهی از متانول تولیدی جهان صرف ساخت سایر مواد شیمیایی می شود. به ویژه متانول ماده آغازگر تولید مواد مهمی مانند فرمالدهید و اسید استیک است که خودشان سنگ بنای تعداد بی شماری از محصولات هستند. فرمالدهید حاصل از متانول در ساخت رزین های اوره ، فرمالدهید و فنولی به کار می رود که به عنوان چسب در تخته های چندلا ، نئوپان و سایر فرآورده های چوبی عمل می کنند. فرمالدهید همچنین در تولید پلاستیک ها و پوشش ها به کار می رود. اسید استیک تولید شده از متانول برای ساخت محصولاتی مانند مونومر وینیل استات جهت ساخت رنگ ها و چسب های پایه PVA و استات سلولز (برای الیاف و فیلم ها) استفاده می شود. علاوه بر این متانول به MTBE (که پیش تر ذکر شد) تبدیل می شود و نیز در ساخت حلال ها و مواد شیمیایی دیگر مانند متیل آمین ها و متیل کلریدها نقش دارد. این واقعیت که متانول میتواند به این همه ترکیب مختلف تبدیل شود ، آن را به سنگ بنای صنعت شیمیایی مدرن تبدیل کرده است. بدون متانول به عنوان خوراک ، تولید گستره عظیمی از پلاستیک ها ، الیاف مصنوعی ، لاستیک ها و مواد شیمیایی که جامعه امروزی به آن وابسته است بسیار دشوارتر می بود. در پایین نمودار درصدی مربوط به سهم منابع خوراک مختلف در تولید جهانی متانول ارائه شده است.
متانول به عنوان سوخت
مدت هاست که به متانول به عنوان سوخت جایگزین برای موتورها توجه می شود. متانول را میت وان مشابه بنزین در موتورهای احتراق داخلی به کار برد ، چه به تنهایی (متانول خالص) و چه به صورت مخلوط با بنزین. برای مثال سوخت M15 (شامل ۱۵٪ متانول و ۸۵٪ بنزین) و M85 (۸۵٪ متانول) در خودروهای سازگار آزمایش و استفاده شده اند. سوخت متانول در خودروهای مسابقه (مانند خودروهای ایندی در گذشته) به طور چشمگیری مورد استفاده بود ، زیرا عدد اکتان بسیار بالایی دارد و می تواند توان خروجی قابل توجهی ایجاد کند. هنگام سوختن ، متانول سوخت دی اکسید کربن و آب تولید می کند و در مقایسه با بنزین معمولی میزان برخی آلاینده ها را کمتر منتشر می کند. متانول هیچ سولفوری در ساختار خود ندارد ، بنابراین اکسیدهای گوگرد در احتراق آن تشکیل نمی شوند و به طور کلی دود و ذرات معلق کمتری نیز تولید می کند. با این حال چگالی انرژی پایین تر متانول به این معنی است که یک خودرو با سوخت متانول نسبت به بنزین مسافت کمتری را با یک باک طی می کند و نیاز به باک بزرگ تر یا سوخت گیری مکرر خواهد داشت. همچنین در سازگاری با مواد خودروها چالش هایی وجود دارد : متانول می تواند برخی فلزات را خورده و به برخی پلاستیک ها و لاستیک ها آسیب برساند بنابراین سامانه سوخت رسانی خودرو باید با قطعات مقاوم در برابر متانول تجهیز شود. با وجود این چالش ها برخی کشورها استفاده از متانول در حمل و نقل را پذیرفته اند ، برای نمونه در چین برنامه های آزمایشی متعددی اجرا شده و هزاران خودرو با مخلوط های متانولی غلظت بالا حرکت می کنند و همچنین متانول به عنوان سوخت در دیگه ای صنعتی برای جایگزینی سوخت های آلاینده تر به کار می رود. در صنعت کشتیرانی نیز متانول در حال ظهور به عنوان یک سوخت دریایی پاک است که می تواند به کشتی ها کمک کند تا مقررات سخت گیرانه انتشار آلاینده ها را رعایت کنند.
ایمنی و سمی بودن متانول
ایمنی در کار با متانول بسیار مهم است ، زیرا این ماده بسیار سمی و آتش گیر است. بدن انسان متانول را به فرمالدهید و اسید فرمیک تبدیل می کند که موجب اسیدوز شدید ، آسیب به عصب بینایی و حتی کوری یا مرگ می شود. حتی ۱۰ میلی لیتر متانول خالص می تواند به بینایی آسیب دائمی وارد کند. علائم مسمومیت شامل سردرد ، سرگیجه ، تهوع ، اختلال بینایی و نارسایی تنفسی است که ممکن است با تاخیر ۱۲ تا ۲۴ ساعته بروز کند. نقطه اشتعال پایین متانول (حدود ۱۱ درجه سلسیوس) آن را بسیار قابل اشتعال کرده و شعله اش نیز تقریبا نامرئی است. در مواجهه با متانول باید از تماس پوستی ، استنشاق بخارات و مصرف آن اجتناب کرد و در صورت بلع یا تماس شدید ، سریعا به پزشک مراجعه نمود.
متانول در مقایسه با اتانول : تفاوت های کلیدی
متانول و اتانول هر دو الکل هایی ساده با ساختار شیمیایی مشابه هستند، اما در خواص ، کاربردها و سمیت تفاوت های اساسی دارند. از نظر ساختاری ، متانول (CH₃OH) یک اتم کربن دارد در حالی که اتانول (C₂H₅OH) دو اتم کربن دارد. اتانول نقطه جوش بالاتر (۷۸ درجه سلسیوس) و محتوای انرژی بیشتری نسبت به متانول (۶۵ درجه سلسیوس) دارد. مهم ترین تفاوت این دو ماده سمیت آن هاست : اتانول در مقادیر کم توسط بدن انسان نسبتا بی خطر است و در نوشیدنی های الکلی کاربرد دارد ، اما متانول بسیار سمی بوده و حتی مصرف مقدار کم آن می تواند منجر به کوری یا مرگ شود. اتانول عمدتا از زیست توده تولید شده و در ضدعفونی کننده ها و سوخت زیستی کاربرد دارد ، در حالی که متانول از گاز طبیعی ، زغالسنگ یا CO₂ تولید شده و به عنوان ماده شیمیایی صنعتی و سوخت تخصصی استفاده می شود.
متانول تجدیدپذیر و سبز
در سال های اخیر ، تولید متانول سبز یا تجدیدپذیر که از منابع پایدار به جای سوخت های فسیلی به دست می آید مورد توجه قرار گرفته است. متانول سبز می تواند از زیست توده هایی مثل پسماندهای کشاورزی و جنگلی یا حتی زباله شهری تولید شود. در این روش مواد اولیه ابتدا به گاز سنتز و سپس به متانول تبدیل می شوند که در صورت مدیریت صحیح می تواند کربن خنثی باشد. روش دیگر شامل تبدیل مستقیم دی اکسید کربن (CO₂) از منابع صنعتی یا حتی جذب از هوا به متانول با استفاده از هیدروژن حاصل از الکترولیز آب (برق تجدیدپذیر) است. این روش ها ضمن کاهش انتشار گازهای گلخانه ای ، راهی برای ذخیره انرژی اضافی حاصل از منابع تجدیدپذیر و استفاده مفید از CO₂ فراهم می کنند. صنایع حمل و نقل دریایی به طور خاص به متانول سبز علاقه دارند و کشتی هایی که با این سوخت پاک حرکت می کنند در حال افزایش اند. هرچند هزینه تولید متانول سبز هنوز بیشتر از متانول معمولی است ، انتظار می رود در آینده نزدیک سهم آن در بازار افزایش چشمگیری یابد و نقش مهمی در گذار به انرژی پایدار ایفا کند.





آشنایی با تعریف و ترکیب شیمیایی متانول و کاربردهای آن
بررسی جداسازی اولیه و کشف متانول و تاریخچه نام گذاری و نام های دیگر متانول
بررسی ساختار مولکولی و فرمول شیمیایی متانول و کاربردهای صنعتی و تجاری آن
آشنایی با خصوصیات کلی متانول (ویژگی ها فیزیکی و شیمیایی پایه) و کاربردهای متداول آن