فهرست عناوین
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 15-05-1404
تاریخ بروزرسانی مقاله : 15-05-1404
تعداد کلمات : 2300
آدرس مقاله : لینک مقاله
تعریف و ترکیب شیمیایی متانول

مقدمه
خرید متانول کاوه فله که یک ترکیب شیمیایی بنیادی است، به طور گسترده در صنعت و علوم استفاده می شود. به عنوان ساده ترین الکل دارای خواص منحصر به فرد و کاربرد های بی شماری است. در این بررسی جامع به تعریف متانول ، ترکیب شیمیایی آن ، ویژگی های فیزیکی و شیمیایی ، روش های تولید ، کاربردهای گوناگون و ملاحظات ایمنی این ماده مهم خواهیم پرداخت.
تعریف متانول
متانول (CH3OH) یک ترکیب شیمیایی آلی است که به خانواده الکل ها تعلق دارد. همچنین با نام هایی مانند الکل متیلیک و الکل چوب شناخته می شود. متانول ساده ترین الکل است و از یک اتم کربن که به سه اتم هیدروژن و یک گروه هیدروکسیل (–OH) متصل شده تشکیل شده است. این ماده مایعی بی رنگ ، سبک و فرار با بویی شبیه به اتانول (الکل نوشیدنی) است. برخلاف اتانول ، متانول برای انسان و حیوانات به شدت سمی است. در گذشته به آن الکل چوب می گفتند زیرا اولین بار از تقطیر چوب به دست آمد.
ترکیب شیمیایی و ساختار
ساختار مولکولی و فرمول شیمیایی متانول بدین صورت است که با فرمول مولکولی CH3OH نشان داده می شود که بیان می کند هر مولکول آن شامل یک اتم کربن ، چهار اتم هیدروژن و یک اتم اکسیژن است. این ترکیب تقریبا شامل ۳۷٫۵٪ کربن ، ۱۲٫۵٪ هیدروژن و ۵۰٪ اکسیژن وزنی می باشد. ساختار متانول متشکل از یک گروه متیل (CH3–) متصل به یک گروه هیدروکسیل (–OH) است. این ساختار ساده ، متانول را به کوچک ترین الکل زنجیره آلی تبدیل می کند. حضور گروه هیدروکسیل به متانول خاصیت قطبی می دهد و امکان ایجاد پیوند هیدروژنی با آب و مولکول های دیگر را فراهم می کند.
خواص فیزیکی متانول
متانول در دمای محیط یک مایع بی رنگ با بویی ملایم و کمی شیرین است. وزن مولکولی کم و نیروهای بین مولکولی ضعیف تر نسبت به الکل های سنگین تر باعث شده نقطه جوش متانول نسبتا پایین و حدود ۶۴٫۷ درجه سانتی گراد و نقطه ذوب آن حدود منفی ۹۷٫۶ درجه سانتی گراد باشد. چگالی متانول حدود ۰٫۷۹۲ گرم بر سانتیمتر مکعب (در ۲۰°C است که یعنی از آب سبک تر است. متانول به طور کامل در آب حل می شود و با الکل ها و بسیاری حلال های آلی دیگر امتزاج پذیر است ، بنابراین خودش نیز یک حلال همه کاره محسوب می شود. متانول با شعله ای تمیز و تقریبا نامرئی می سوزد و می تواند با هوا مخلوط های انفجاری تشکیل دهد. این ویژگی های فیزیکی تعیین می کنند که متانول چگونه در کاربردهای مختلف جابه جا و استفاده شود. جدول زیر برخی از خواص فیزیکی و شیمیایی کلیدی متانول را نشان می دهد:
| ویژگی | مقدار | واحد | توضیحات | اهمیت |
|---|---|---|---|---|
| فرمول شیمیایی | CH3OH | — | متشکل از یک اتم کربن، چهار هیدروژن و یک اکسیژن | سادهترین الکل؛ مشخصه اصلی متانول |
| جرم مولی | ۳۲٫۰۴ | گرم بر مول | جرم یک مول متانول | وزن مولکولی پایین که باعث فراریت بالای متانول می شود |
| ظاهر | مایع بی رنگ | — | مایع شفاف شبیه آب | ممکن است با آب اشتباه گرفته شود؛ به راحتی با مایعات دیگر مخلوط می شود |
| چگالی | ۰٫۷۹۲ | گرم بر سانتیمتر مکعب | جرم واحد حجم (در ۲۰°C) | از آب سبکتر؛ به راحتی در آب حل می شود |
| نقطه جوش | ۶۴٫۷ | °C | دمای جوش متانول | پایین، نشان دهنده تبخیر سریع |
| نقطه ذوب | منفی ۹۷٫۶ | °C | دمای انجماد متانول | حتی در سرمای شدید نیز مایع باقی می ماند |
| نقطه اشتعال | حدود ۱۱ | °C | کمترین دما که بخارات متانول مشتعل می شوند | قابلیت اشتعال بالا حتی در دمای کم (خطر آتش سوزی) |
| حلالیت در آب | کاملاً قابل اختلاط | — | قابلیت اختلاط با آب در هر نسبتی | به آسانی رقیق شده و در محیط پراکنده می شود |
خواص شیمیایی متانول
از نظر شیمیایی ، متانول مانند سایر الکل های سبک رفتار می کند اما ویژگی های خاص خود را نیز دارد. متانول یک حلال قطبی پروتیک است ، یعنی می تواند هیدروژن اهدا کند و قادر است طیف گسترده ای از مواد را حل کند. متانول بسیار اشتعال پذیر است ؛ در حضور اکسیژن دچار احتراق شده و دی اکسید کربن و آب تولید می کند برای مثال: ۲ CH3OH + 3 O2 → 2 CO2 + 4 H2O). در حضور کاتالیزورها یا آنزیم های معین ، متانول می تواند به فرمالدهید و در ادامه به اسید فرمیک اکسید شود. همین اکسید شدن در بدن انسان عامل سمی بودن متانول است. متانول با اسیدهای آلی واکنش داده و استرهای متیل تولید می کند (مثلا با اسید استیک ، استات متیل تشکیل می شود). همچنین با اسیدهای معدنی مانند اسید کلریدریک واکنش کرده و کلرومتان (متیل کلرید) تولید می کند. متانول به عنوان یک الکل کوچک می تواند در حضور باز قوی ، پروتون خود را از دست بدهد و یون متوکسید (CH3O−) تشکیل دهد که یک باز و نوکلئوفیل مفید در شیمی آلی است.
تولید صنعتی متانول
در گذشته متانول از تقطیر مخرب چوب تولید می شد و به همین دلیل الکل چوب نام داشت. امروزه متانول به صورت صنعتی از ترکیب کاتالیستی گاز سنتز شامل کربن مونوکسید و هیدروژن تولید می شود. گاز سنتز (سینگاز) معمولا از گاز طبیعی ، زغال سنگ یا زیست توده به دست آمده و در مجاورت کاتالیزورهایی مانند مس ، اکسید روی و آلومینا در دما و فشار بالا به متانول تبدیل می شود. در صورت وجود دی اکسید کربن آن هم می تواند به متانول تبدیل شود که محصول جانبی آن آب است. تولید جهانی متانول امروزه به ده ها میلیون تن در سال می رسد. همچنین علاقه فزاینده ای به متانول سبز وجود دارد که از منابع تجدیدپذیر یا CO₂ جذب شده ساخته می شود. روش های زیستی (مانند تبدیل متان به متانول توسط باکتری ها) نیز وجود دارد ، اما هنوز در مقیاس صنعتی چندان قابل توجه نیستند.
پیشینه تاریخی متانول
سابقه استفاده از متانول به دوران باستان باز می گردد حتی اگر در آن زمان ماهیت شیمیایی آن شناخته شده نبود. مصریان باستان در فرآیند مومیایی کردن از مخلوط هایی استفاده می کردند که شامل متانول بود (متانول را از طریق پیرولیز چوب به دست می آوردند). اولین جداسازی متانول خالص توسط شیمیدان ایرلندی رابرت بویل در سال ۱۶۶۱ انجام شد ؛ او متانول را از تقطیر چوب جعبه (باکسوود) استخراج کرد. در قرن نوزدهم پژوهش درباره متانول پیشرفت کرد : در سال ۱۸۳۴ شیمی دانان فرانسوی ژان باتیست دوما و اوژن پلیگو ترکیب عنصری متانول را تعیین کردند و واژه متیل را (از کلمات یونانی به معنای شراب و چوب) برای توصیف جزء موجود در الکل چوب ابداع کردند. نام متانول خودش در سال ۱۸۹۲ توسط کنفرانس بین المللی نام گذاری شیمیایی به عنوان نام رسمی الکل متیلیک معرفی شد. در سال ۱۹۰۵ شیمیدان فرانسوی پل ساباتیه یک روش برای سنتز متانول از CO2 و H2کشف کرد که راه را برای روش تولید مدرن هموار ساخت. اولین فرایند صنعتی عمده برای سنتز متانول توسط شرکت BASF در دهه ۱۹۲۰ در آلمان توسعه یافت که در آن از گاز سنتز در فشار بسیار بالا و کاتالیزورهای روی/کروم استفاده می شد. تا اواسط قرن بیستم کاتالیزورهای بهبود یافته مانند کاتالیزورهای پایه مس توسط شرکت ICI در دهه ۱۹۶۰ امکان تولید متانول در فشارهای پایین تر و بازده بالاتر را فراهم کردند. در طی جنگ جهانی دوم ، متانول به عنوان جزئی از سوخت راکتی با نام M-Stoff در آلمان به کار رفت. بعدا در جریان بحران های نفتی دهه ۱۹۷۰، متانول به عنوان سوخت جایگزین برای خودروها مورد توجه قرار گرفت. تولید و استفاده از متانول از آن زمان به شدت افزایش یافته و امروز متانول به یک ماده شیمیایی اساسی در مقیاس جهانی تبدیل شده است.
کاربردهای متانول
متانول به دلیل خواص شیمیایی منحصربه فرد خود ، به عنوان ماده ای چند منظوره کاربردهای گسترده ای در صنایع مختلف دارد. بخش عمده ای از متانول به عنوان خوراک اولیه برای تولید سایر مواد شیمیایی از جمله فرمالدهید ، اسید استیک ، پلاستیک ها و رزین ها استفاده می شود. علاوه بر این متانول کاربرد فراوانی به عنوان سوخت دارد ، از افزودنی در بنزین تا استفاده مستقیم در موتورهای خاص و سلول های سوختی برای تولید برق. ویژگی حل کنندگی بالای متانول نیز باعث شده که در آزمایشگاه ها و فرایندهای صنعتی به عنوان حلال کاربرد گسترده ای داشته باشد. همچنین از آن به عنوان ماده ضدیخ در مایعات شیشه شوی خودرو استفاده می شود. متانول به عنوان افزودنی دناتوره کننده ، اتانول صنعتی را سمی و غیر قابل مصرف می کند. کاربردهای دیگر آن شامل استفاده در تولید بیودیزل از روغن های گیاهی ، تمیزکننده صنعتی و حتی تصفیه فاضلاب جهت حذف نیترات ها می باشد. این تنوع باعث شده متانول در زندگی روزمره و صنایع مختلف نقشی کلیدی داشته باشد.
متانول به عنوان ماده اولیه صنعتی
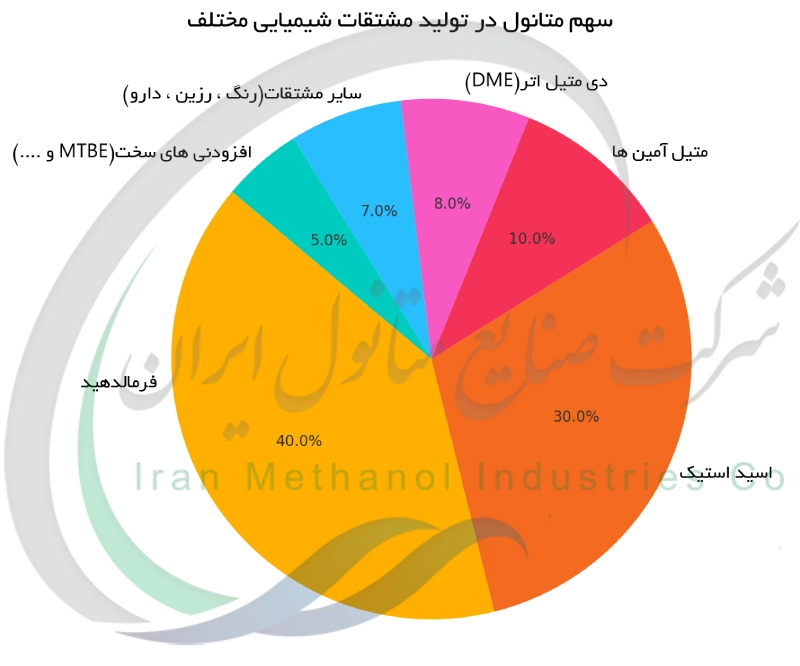
یکی از مهم ترین نقش های متانول خدمت به عنوان خوراک (ماده اولیه) برای سنتز سایر مواد شیمیایی است. متانول سنگ بنای صنعت فرمالدهید است : درصد قابل توجهی از متانول جهان به اکسیداسیون و تولید فرمالدهید اختصاص می یابد که خود در ساخت پلاستیک ها ، رزین ها (مانند رزین اوره-فرمالدهید و فنل-فرمالدهید) و چسب ها به کار می رود. مشتق مهم دیگر متانول اسید استیک است. از طریق فرآیندهایی مانند مونسانتو و کاتیوا ، متانول با کربن مونوکسید ترکیب (کربونیله) می شود تا اسید استیک تولید گردد، که ماده ای کلیدی در ساخت پلیمرهایی چون PET و حلال های مختلف است. متانول با ایزو بوتیلن واکنش داده و متیل ترت-بوتیل اتر (MTBE) را تولید می کند که به عنوان افزودنی بنزین برای بهبود عدد اکتان و کاهش کوبش موتور به کار رفته است. متانول همچنین برای تولید متیل آمین ها (از واکنش با آمونیاک) استفاده می شود که در ساخت داروها و مواد شیمیایی کشاورزی کاربرد دارند. مشتق دیگر دی متیل اتر (DME)، از آب گیری متانول به دست می آید ؛ DME یک پیشرانه آئروسل مفید و سوخت پاک بالقوه است. به طور خلاصه نقش متانول به عنوان یک مولکول سازنده در صنعت شیمیایی بسیار عظیم است ، از پلاستیک ها تا رنگ ها ، بسیاری از محصولات ریشه در شیمی متانول دارند. این نمودار درصدی ، سهم متانول در تولید مشتقات شیمیایی مختلف را به عنوان ماده اولیه صنعتی نمایش می دهد.
متانول به عنوان حلال و ضدیخ
در آزمایشگاه ها و صنعت ، متانول به عنوان یک حلال رایج استفاده می شود. قابلیت متانول در حل کردن ترکیبات قطبی و حتی برخی ترکیبات غیرقطبی (به دلیل داشتن گروه قطبی هیدروکسیل و گروه ناقطبی متیل) آن را برای واکنش های شیمیایی و استخراج ها مفید می سازد. متانول با آب و بسیاری از مایعات آلی امتزاج پذیر است به این معنی که می تواند محلول های یکنواخت در گستره وسیعی از ترکیبات ایجاد کند. افزون بر این متانول به عنوان یک ماده ضد یخ به کار رفته است. متانول نقطه انجماد آب را کاهش می دهد و به همین دلیل در ضدیخ های اولیه خودرو و در مایع شیشه شوی خودروها استفاده می شد تا از یخ زدن آنها در هوای سرد جلوگیری شود. (با این حال به دلیل سمی بودن متانول استفاده از آن در محصولات ضدیخ مصرفی مانند شیشه شوی در برخی مناطق محدود یا ممنوع شده و به جای آن از جایگزین های کم خطرتر استفاده می شود.) متانول همچنین به خطوط لوله (مثل خطوط نفت و گاز طبیعی) تزریق می شود تا از تشکیل یخ و هیدرات ها جلوگیری کند. در زندگی روزمره بسیاری از افراد با متانول به شکل جزئی از الکل صنعتی یا سوخت چراغ های کمپینگ مواجه می شوند. ویژگی حلال و ضدیخ بودن متانول ، همراه با فراریت آن باعث شده در محصولات پاک کننده ، تینرهای رنگ و افزودنی های سوخت (برای جذب آب) مورد استفاده قرار گیرد. یکی از کاربردهای اصلی متانول در خودروهای امروزی به عنوان ماده ضدیخ در لوله های سوخت و جذبکننده آب است که کمک می کند خطوط سوخت در زمستان یخ نزنند.
سمیت و ایمنی متانول
متانول برای انسان و بسیاری از جانوران به شدت سمی است. حتی مقدار کمی متانول در صورت نوشیده شدن (حدود ۱۰ میلی لیتر متانول خالص) می تواند باعث کوری دائمی شود و کمی بیشتر می تواند کشنده باشد. خطر متانول ناشی از چگونگی سوخت و ساز آن در بدن است : کبد متانول را به فرمالدهید و سپس به اسید فرمیک تبدیل می کند که می تواند منجر به اسیدوز متابولیک افت خطرناک pH خون و آسیب عصب بینایی شود. علائم مسمومیت با متانول شامل سردرد ، سرگیجه ، حالت تهوع ، عدم تعادل ، تاری دید و در موارد شدید بیهوشی یا مرگ است. نکته مهم این است که علائم ممکن است چند ساعت پس از مواجهه ظاهر نشوند و این تاخیر می تواند مسمومیت با متانول را فریبنده کند. یک پادزهر برای متانول وجود دارد : پزشکان از اتانول (الکل معمولی) یا دارویی به نام فومپیزول برای درمان مسمومیت با متانول استفاده می کنند. این مواد با جلوگیری از متابولیسم متانول به محصولات سمی اش عمل می کنند. از دیدگاه ایمنی کار با متانول نیاز به احتیاط دارد. متانول تا حدی از طریق پوست جذب می شود و بخارات آن در صورت تنفس در مقادیر زیاد می تواند مضر باشد، بنابراین تهویه مناسب ، دستکش و محافظ چشم هنگام کار با متانول ضروری است. چون متانول قابل اشتعال است ، باید آن را دور از جرقه و شعله نگهداری کرد و در ظروف دربسته نگه داشت. آتش متانول به سختی دیده می شود (در نور روز شعله تقریبا نامرئی است) ، بنابراین برای ایمنی در برابر آتش متانول لازم است از آشکارسازهای شعله یا افزودنی هایی استفاده شود که به شعله رنگ قابل مشاهد های بدهند. هر کسی که با متانول سر و کار دارد باید از خطرات آن آگاه باشد و دستورالعمل های ایمنی را به طور کامل رعایت کند.
متانول در مقابل اتانول : تفاوت های کلیدی
متانول و اتانول هر دو ترکیب الکلی هستند اما تفاوت های زیادی از نظر ساختار ، خواص و کاربردها دارند. متانول (CH₃OH) دارای یک کربن بوده و به شدت سمی است، به گونه ای که مصرف مقدار کم آن ممکن است به کوری یا حتی مرگ منجر شود ، در حالی که اتانول (C₂H₅OH) ، با دو اتم کربن ، همان الکل موجود در نوشیدنی ها است که در حد متعارف کمتر خطرناک می باشد. نقطه جوش متانول (۶۴٫۷ درجه سانتی گراد) پایین تر از اتانول (۷۸٫۴ درجه سانتی گراد) است ، بنابراین متانول سریع تر تبخیر می شود. همچنین اتانول نسبت به متانول دارای انرژی بیشتری است (۲۴ در مقابل ۱۶ مگاژول بر لیتر). شعله متانول تقریبا نامرئی و آبی کمرنگ است ، در حالی که شعله اتانول به رنگ آبی مایل به زرد قابل رویت است. اتانول در نوشیدنی ها ، ضدعفونی کننده ها و افزودنی های سوخت به کار می رود ، اما متانول عمدتا در سنتز شیمیایی ، سوخت های ویژه و به عنوان حلال صنعتی استفاده می شود.




