فهرست عناوین
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 21-06-1404
تاریخ بروزرسانی مقاله : 21-06-1404
تعداد کلمات : 2700
آدرس مقاله : لینک مقاله
ساختار مولکولی و فرمول شیمیایی متانول

مقدمه
متانول یک الکل ساده با یک اتم کربن و فرمول شیمیایی CH3OH است. متانول ساده ترین عضو خانواده الکل می باشند و با نام های متیل الکل (الکل متیلیک) یا الکل چوب نیز شناخته می شود. این مایع بی رنگ و قابل اشتعال بویی ملایم و کمی شیرین شبیه به اتانول دارد. خرید متانول تهران تانکر به طور گسترده در صنایع شیمیایی به عنوان حلال، سوخت و ماده اولیه برای تولید سایر مواد شیمیایی استفاده می شود. در ادامه ساختار مولکولی، فرمول شیمیایی، خواص، کاربردها و اهمیت متانول بررسی شده و توضیح داده می شود که چگونه ساختار منحصر به فرد آن بر رفتار و کاربردهایش تأثیر میگذارد.
فرمول شیمیایی متانول
فرمول شیمیایی متانول CH3OH است و نشان می دهد که هر مولکول از یک اتم کربن، چهار اتم هیدروژن و یک اتم اکسیژن تشکیل شده است. این فرمول را می توان به صورت CH4O نیز نوشت که ترکیب اتمی یکسانی را نشان می دهد. فرمول متانول حاکی از آن است که این ترکیب دارای یک گروه متیل (CH3–) متصل به یک گروه هیدروکسیل (–OH) است. وزن مولکولی متانول حدود ۳۲٫۰۴ گرم بر مول است و متانول کوچک ترین الکل ممکن به شمار می آید. ساختار تک کربنه متانول آن را از الکل های بزرگ تر مانند اتانول (C2H5OH) متمایز می کند. وجود گروه عاملی –OH در فرمول متانول نشان دهنده الکل بودن آن است. این فرمول ساده اهمیت صنعتی متانول را پنهان می کند، چرا که متانول یک ماده پایه اساسی در صنعت به شمار می رود.
فرمول ساختاری و پیوندهای متانول
فرمول ساختاری متانول معمولاً به صورت CH3–OH نوشته می شود که نشان می دهد یک گروه متیل (CH3) مستقیماً به یک گروه هیدروکسیل (OH) متصل است. در مولکول متانول، اتم کربن با سه اتم هیدروژن و یک اتم اکسیژن پیوند کووالانسی یگانه برقرار کرده است. اتم اکسیژن نیز به نوبه خود به اتم کربن و یک اتم هیدروژن (هیدروژن گروه هیدروکسیل) متصل شده است. تمام پیوندهای موجود در متانول یگانه (سیگما) هستند و هیچ پیوند دوگانه یا سه گانه ای در آن وجود ندارد. این آرایش پیوندی باعث می شود قاعده ظرفیت چهارگانه کربن و ظرفیت دوگانه اکسیژن رعایت شود. پیوند C–O و پیوند O–H در متانول از نوع کووالانسی قطبی هستند، زیرا اکسیژن به دلیل الکترونگاتیوی بالاتر، الکترون های پیوندی را بیشتر به سوی خود می کشد. در نتیجه اکسیژن دارای بار منفی جزئی و کربن و هیدروژن ها دارای بار مثبت جزئی می شوند. نحوه اتصال ساختاری (CH3–OH) نشان می دهد که می توان متانول را به صورت یک مشتق از متان (CH4) در نظر گرفت که در آن یک اتم هیدروژن با یک گروه هیدروکسیل جایگزین شده و این جایگزینی خصوصیات مولکول را به کلی تغییر داده است.
هندسه مولکولی متانول
هندسه مولکولی متانول ناشی از آرایش چهاروجهی پیوندها در اطراف اتم کربن مرکزی است. کربن در CH3OH هیبریداسیون sp3 دارد، به این معنی که چهار اوربیتال پیوندی آن تقریباً با زاویه ۱۰۹٫۵ درجه به شکل چهاروجهی قرار گرفته اند. سه پیوند C–H و یک پیوند C–O از اتم کربن با آرایش چهار وجهی خارج می شوند. اتم اکسیژن در گروه هیدروکسیل نیز هندسه الکترونی چهار وجهی هیبریداسیون sp3دارد و دارای دو جفت الکترون ناپیوندی و دو پیوند (یکی با کربن و یکی با هیدروژن) است. بنابراین پیوند O–H در متانول با زاویه ای نسبت به پیوند C–O قرار گرفته که شبیه به ساختار خمیده مولکول H2O است. زاویه بین پیوندهای H–C–H در گروه متیل حدود ۱۰۹° و زاویه C–O–H حدود ۱۰۸° است. در کل مولکول متانول مسطح نیست و دارای شکلی سه بعدی است که در آن گروه OH از گروه CH3 فاصله گرفته و بیرون زده است. این ساختار فضایی بر خواص فیزیکی متانول و نحوه برهم کنش آن با سایر مولکول ها تأثیر می گذارد.
گروه عاملی و طبقه بندی متانول به عنوان یک الکل
متانول دارای گروه عاملی هیدروکسیل (–OH) است که آن را در رده الکل ها قرار می دهد. در حقیقت متانول ساده ترین الکل نوع اول است؛ به این معنا که گروه –OH آن به اتم کربنی متصل است که با هیچ اتم کربن دیگری پیوند ندارد (فقط به هیدروژن متصل است). حضور گروه هیدروکسیل مسئول بسیاری از خواص و واکنش های شاخص متانول است. به عنوان اولین عضو در سری الکل های آلیفاتیک، متانول الگوی اولیه ای برای الکل های بزرگ تر (اتانول، پروپانول و غیره) محسوب می شود که هر یک یک واحد –CH2بیشتر دارند. نام متانول از کلمه متیل گرفته شده که نشان دهنده گروه متیل در ساختار آن است و پسوند -ول نیز پسوندی برای نام گذاری الکل هاست. متانول که در گذشته الکل چوب نامیده می شد (به دلیل تولید از چوب)، به واسطه گروه عاملی خود می تواند در واکنش های معمول الکل ها (مانند تشکیل استرها یا اترها) شرکت کند. ساختار ساده متانول که از اتصال یک گروه متیل به یک گروه هیدروکسیل تشکیل شده است، آن را به یک نقطه مرجع مهم در شیمی آلی برای درک رفتار و نام گذاری الکل ها تبدیل کرده است.
قطبیت و پیوند هیدروژنی
متانول یک مولکول قطبی است و این قطبیت ناشی از اختلاف الکترونگاتیوی قابل توجه بین بخش کربن-هیدروژن و اتم اکسیژن در گروه هیدروکسیل آن است. پیوند O–H در متانول به ویژه قطبی است و به اکسیژن بار منفی جزئی و به هیدروژن بار مثبت جزئی می دهد. در نتیجه مولکول های متانول می تواند با یکدیگر و با ترکیبات دیگر پیوند هیدروژنی تشکیل دهد. در متانول مایع، هر مولکول می تواند از طریق جاذبه بین اتم اکسیژن یک مولکول و اتم هیدروژن گروه OH مولکول دیگر پیوند هیدروژنی برقرار کند. این برهم کنش های پیوند هیدروژنی برای چنین مولکول کوچکی نسبتاً قوی هستند و باعث می شوند نقطه جوش متانول نسبت به مولکول های غیرقطبی با وزن مولکولی مشابه بالاتر باشد. برای مثال متان (CH4) قطبی نیست و در دمای –۱۶۱°C به جوش می آید، در حالی که متانول (CH3OH) به دلیل توانایی تشکیل پیوند هیدروژنی در حدود ۶۴٫۷°C می جوشد. قطبیت متانول همچنین باعث می شود که این ماده با آب به هر نسبتی امتزاج پذیر باشد، هر دو مایع به راحتی با هم مخلوط می شوند زیرا متانول می تواند با مولکول های آب پیوند هیدروژنی برقرار کند. ترکیب یک گروه هیدروکسیل قطبی و یک بخش هیدروکربنی کوچک به متانول این امکان را می دهد که هم مواد قطبی و هم تا حدی مواد غیرقطبی را حل کند و در نتیجه حلالی همه کاره باشد.
خواص فیزیکی متانول
متانول در دمای محیط یک مایع شفاف، بی رنگ و با بوی الکلی ملایم است. نقطه ذوب آن ۹۷٫۶°C و نقطه جوش آن حدود ۶۴٫۷°C است، بنابراین در بازه گسترده ای از دما به حالت مایع باقی می ماند. چگالی متانول در حدود ۰٫۷۹ گرم بر سانتی متر مکعب در ۲۰°C است که کمتر از آب است (روی آب شناور می شود). متانول بسیار فرار است و به دلیل نقطه جوش نسبتاً پایین و وزن مولکولی کم، به سرعت تبخیر می شود. این ترکیب همچنین قابل اشتعال است؛ متانول با شعله آبی کم رنگی می سوزد که ممکن است در نور روز تقریباً نامرئی باشد. از نظر گرانروی، متانول مایعی سبک و روان است گرانروی در ۲۵°C حدود ۰٫۵۵ میلی پاسکالثانیه است که تقریباً نصف گرانروی آب می باشد. ضریب شکست متانول حدود ۱٫۳۳ است که مشابه آب است. بوی متانول تا حدی شیرین و شبیه اتانول است، اگرچه به دلیل سمی بودن نباید آن را چشید یا عمیقاً استشمام کرد. از نظر فیزیکی، اندازه کوچک و وجود گروه OH قطبی در متانول باعث می شود که این ماده به طور کامل در آب حل شود و نیز با بسیاری از حلال های آلی امتزاج پیدا کند. این ویژگی های فیزیکی، نقطه انجماد پایین، قدرت حلالیت خوب و فراریت بالا زیربنای بسیاری از کاربردهای عملی متانول هستند (برای مثال به عنوان ضدیخ و به عنوان حلال پاک کننده).
روش های تولید و سنتز متانول
متانول زمانی عمدتاً از تقطیر مخرب چوب تولید می شد و به همین دلیل به الکل چوب معروف بود. در آن فرآیند قدیمی، با حرارت دادن چوب در غیاب هوا، متانول ناخالص همراه با ترکیبات دیگر به دست می آمد. این موضوع بخشی از تاریخچه نام گذاری و نام های دیگر متانول است، چرا که نام هایی مانند الکل چوب یا الکل متیلیک از همین روش های قدیمی استخراج شده اند. امروزه متانول عمدتاً به صورت صنعتی از گاز سنتز (سینگاز) تولید می شود؛ گاز سنتز مخلوطی از مونوکسید کربن (CO) و هیدروژن (H2) است. روش تجاری اصلی شامل واکنش CO و H2 روی یک کاتالیزور (معمولاً اکسیدهای مس، روی و آلومینیوم) تحت فشار بالا و دمای معتدل برای تولید CH3OH است. واکنش سنتز را به طور ساده می توان به صورت CO + ۲ H2 → CH3OH نشان داد. کارخانجات مدرن، گاز سنتز را از گاز طبیعی (متان) از طریق ریفرمینگ با بخار یا در برخی موارد از طریق گازسازی زغال سنگ به دست می آورند. همچنین می توان متانول را بهطور تجدیدپذیر با استفاده از هیدروژن حاصل از الکترولیز آب و دی اکسید کربن گرفته شده از جو یا گازهای صنعتی تولید کرد که محصولی به نام متانول سبز حاصل می شود. تولید جهانی متانول سالانه ده ها میلیون تن است که اهمیت آن را به عنوان یک ماده شیمیایی پایه نشان می دهد. در طبیعت تنها مقادیر اندکی متانول به صورت زیستی تشکیل می شود (مثلاً توسط فعالیت های برخی باکتری ها و گیاهان در محیط)، بنابراین تقریباً تمام متانول مورد نیاز جهان از سنتز صنعتی تأمین می شود.
کاربردهای صنعتی و تجاری متانول
کاربردهای متانول بسیار متنوع و گسترده است و صنایع بسیاری را شامل می شود. بخش عمده ای از متانول به عنوان ماده اولیه برای تولید سایر مواد شیمیایی استفاده می شود. یکی از مهم ترین مشتقات متانول فرمالدهید است که از اکسیداسیون متانول به دست می آید؛ فرمالدهید خود در تولید رزین ها، پلاستیک ها و چسب ها به طور وسیع به کار می رود. متانول همچنین از طریق فرایندهایی مانند روش مونسانتو و کاتیوا به اسید استیک تبدیل می شود و اسید استیک نیز برای تولید پلیمرها، الیاف و حلال ها کاربرد دارد. یکی دیگر از کاربردهای مهم متانول، تولید متیل ترشیری بوتیل اتر (MTBE) است که یک افزودنی بنزین برای بالا بردن عدد اکتان و بهبود احتراق محسوب می شود. خود متانول نیز به عنوان یک حلال در آزمایشگاه ها و صنایع به صورت مستقیم کاربرد دارد زیرا قابلیت حل کردن گستره وسیعی از ترکیبات را دارد؛ از متانول در محصولاتی مانند رنگ ها، جوهرها و پاک کننده ها استفاده می شود. در بخش انرژی متانول به عنوان ماده ضدیخ در مایع شیشه شوی خودروها و در خطوط لوله گاز طبیعی به کار می رود، زیرا نقطه انجماد آب را کاهش می دهد. متانول همچنین ماده کلیدی در تولید بیودیزل است و با واکنش با روغن های گیاهی یا چربی های حیوانی، استرهای متیل اسیدهای چرب (سوخت بیودیزل) را تولید می کند. علاوه بر این از متانول به عنوان ماده افزودنی برای غیرقابل شرب کردن اتانول صنعتی استفاده می شود. گستردگی کاربردهای متانول ناشی از ساختار ساده و واکنش پذیری آن است که این ماده را هم به یک حلال خوب و هم یک بلوک سازنده مناسب برای سنتز ترکیبات آلی بزرگ تر تبدیل کرده است.
متانول به عنوان سوخت
متانول به عنوان سوخت در برخی موتورها و سیستم های انرژی استفاده می شود. در مسابقات اتومبیل رانی حرفه ای مانند سری مسابقات IndyCar، از متانول به عنوان سوخت استفاده می شود زیرا عدد اکتان بالایی (بیش از ۱۰۰) دارد و این ویژگی امکان کار کردن موتور در نسبت تراکم های بالاتر و توان خروجی بیشتر را فراهم می کند. متانول همچنین با دمای احتراق پایین تر و دوده کمتر نسبت به بنزین می سوزد که می تواند عمر موتور را افزایش داده و آلودگی هوا را کاهش دهد. متانول را می توان برای افزایش عدد اکتان به بنزین افزود، هرچند که معمولاً به جای آن از اتانول برای این منظور بیشتر استفاده می شود. یکی از چالش ها این است که محتوای انرژی متانول تنها حدود نصف انرژی در هر لیتر بنزین است، به این معنا که یک خودروی با سوخت متانول خالص، مگر آنکه موتور آن به طور خاص بهینه سازی شود، مسافت کمتری را با یک حجم سوخت مشخص طی می کند. متانول همچنین در پیل های سوختی مورد مطالعه قرار گرفته است؛ پیل سوختی متانولی مستقیم (DMFC) می تواند بدون فرایند احتراق و به طور الکتروشیمیایی از متانول برق تولید کند که برای تأمین انرژی خودروهای برقی یا دستگاه های قابل حمل جذاب است. اگرچه استفاده از متانول به عنوان سوخت نیاز به احتیاط فراوان دارد (به دلیل سمی بودن و شعله نامرئی آن)، اما با رعایت ایمنی متانول همچنان به عنوان یک سوخت جانشین و حامل انرژی امیدوارکننده برای آینده مطرح است.
سمیت و نکات ایمنی
متانول برای انسان و بسیاری از جانوران بسیار سمی است. برخلاف اتانول (الکل نوشیدنی)، متانول حتی در مقادیر کم نیز خطرناک است و نباید مصرف شود حتی مقدار اندک آن می تواند آسیب جدی وارد کند. علت اصلی سمی بودن متانول نحوه متابولیزه شدن آن در بدن است: کبد متانول را به فرمالدهید و سپس به اسید فرمیک تبدیل می کند که در بدن تجمع یافته و به عصب بینایی و سایر اندام ها آسیب می رساند. تنها ۱۰ تا ۱۵ میلی لیتر متانول خالص (حدود یک قاشق غذاخوری) می تواند با تخریب عصب بینایی باعث کوری دائمی شود و حدود ۳۰ میلی لیتر یا بیشتر می تواند بدون درمان فوری کشنده باشد. علائم مسمومیت با متانول ممکن است در ابتدا خفیف باشند (مانند خواب آلودگی، سردرد، تهوع) اما پس از گذشت چند ساعت، اسیدوز شدید متابولیک، تاری دید و نارسایی اندام ها بروز می کند. از آنجا که متانول بویی ملایم و مزه ای نسبتاً شبیه اتانول دارد، گاهی مصرف تصادفی یا عمدی آن (مثلاً در موارد مشروبات الکلی تقلبی) رخ می دهد و منجر به موارد مسمومیت جمعی می شود. رعایت دقیق نکات ایمنی هنگام کار با متانول حیاتی است. همیشه باید از دستکش و محافظ چشم استفاده کرده و از تماس پوست و چشم با متانول جلوگیری شود، همچنین در محیط های دارای تهویه مناسب کار شود تا از تنفس بخارات آن اجتناب گردد و متانول را دور از جرقه و شعله نگهداری کنید زیرا بهراحتی آتش می گیرد. متانول با شعله ای تقریباً نامرئی می سوزد، بنابراین وقوع آتش سوزی آن ممکن است بلافاصله تشخیص داده نشود. در صورت بلع تصادفی یا مواجهه شدید با متانول، فوراً باید کمک پزشکی دریافت شود؛ پادزهرهایی مانند اتانول یا فومپیزول می توانند متابولیسم سمی متانول را کند کنند. به دلیل این مخاطرات برچسب گذاری واضح ظروف حاوی متانول و نگهداری دقیق آن در محیط های صنعتی و آزمایشگاهی کاملاً ضروری است.
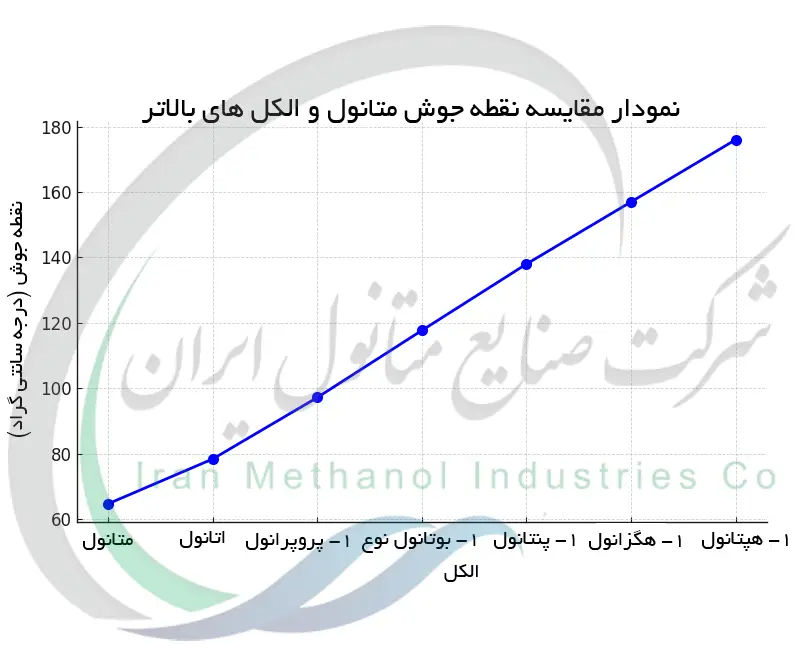
مقایسه متانول با سایر الکل ها
متانول نخستین عضو سری الکل ها است و می توان ویژگی های آن را در مقایسه با الکل های سنگین تر مانند اتانول، پروپانول و بوتانول بررسی کرد. هر الکل در این سری نسبت به الکل قبلی خود یک واحد –CH2– اضافی در ساختار مولکولی دارد که این افزایش طول زنجیر بر خواص فیزیکی و شیمیایی تأثیر می گذارد. برای مثال اتانول (C2H5OH) دارای دو اتم کربن است و سمیت حادتری ندارد. اتانول همان الکل موجود در نوشیدنی هاست در حالی که متانول با یک کربن بسیار سمی تر است. اتانول در ۷۸٫۴°C می جوشد که بالاتر از نقطه جوش ۶۴٫۷°C متانول است زیرا مولکول بزرگ تر اتانول علاوه بر پیوند هیدروژنی، نیروهای بین مولکولی قوی تری (نیروهای واندروالسی بیشتر) دارد. به همین ترتیب 1-پروپانول (C3H7OH) در حدود ۹۷°C و 1-بوتانول (C4H9OH) در حدود ۱۱۷٫۷°C به جوش می آیند که روند افزایش نقطه جوش با بلندتر شدن زنجیر کربنی را نشان می دهد. جدول زیر برخی خواص کلیدی متانول و چند الکل سبک را مقایسه کرده است:
| نام | فرمول شیمیایی | جرم مولی (گرم/مول) | نقطه جوش (°C) | حلالیت در آب |
|---|---|---|---|---|
| متانول | CH3OH | ۳۲٫۰۴ | ۶۴٫۷ | کاملا محلول |
| اتانول | C2H5OH | ۴۶٫۰۷ | ۷۸٫۴ | کاملا محلول |
| 1-پروپانول | C3H7OH | ۶۰٫۱۰ | ۹۷٫۲ | کاملا محلول |
| 1-بوتانول | C4H9OH | ۷۴٫۱۲ | ۱۱۷٫۷ | ~۷٫۷% (w/w) در ۲۰°C |
| 1-پنتانول | C5H11OH | ۸۸٫۱۵ | ۱۳۸٫۰ | ~۲٫۳% (w/w) در ۲۰°C |
| 1-هگزانول | C6H13OH | ۱۰۲٫۱۷ | ۱۵۷ | ~۰٫۶% (w/w) در ۲۰°C |
| 1-هپتانول | C7H15OH | ۱۱۶٫۲۱ | ۱۷۶ | ~۰٫۱% (w/w) در ۲۰°C |
همان طور که مشاهده می شود، با افزایش طول زنجیر کربنی در الکل ها، نقطه جوش بالاتر و میزان حلالیت در آب کمتر می شود. متانول به دلیل ساختار مولکولی کوچکش دارای کمترین نقطه جوش است و به طور کامل در آب حل می شود، در حالی که الکل های زنجیر بلندتر مثل هگزانول و هپتانول نقاط جوش بسیار بالاتری دارند و تقریباً در آب نامحلول اند. این تفاوت ها نشان می دهد که اندازه و ساختار مولکولی تا چه حد می تواند بر خواص فیزیکی الکل ها تأثیر بگذارد.




