فهرست عناوین
- مقدمه
- متانول و اتانول: آشنایی با مفاهیم پایه
- تفاوت در ساختار شیمیایی و ترکیب
- ویژگی های فیزیکی متانول به طور خلاصه
- ویژگی های فیزیکی اتانول به طور خلاصه
- نقطه جوش متانول و فراریت آن
- نقطه جوش اتانول به صورت دقیق تر
- چرا نقطه جوش اتانول از متانول بالاتر است
- نقطه انجماد متانول و رفتار آن در دماهای پایین
- نقطه انجماد اتانول و رفتار آن در دماهای پایین
- چرا نقطه انجماد اتانول از متانول پایین تر است
- نیروهای بین مولکولی: تأثیر بر نقطه جوش و انجماد
- نتیجه گیری: مقایسه ویژگی های دمایی متانول و اتانول
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 17-09-1404
تاریخ بروزرسانی مقاله : 17-09-1404
تعداد کلمات : 3500
آدرس مقاله : لینک مقاله
نقطه جوش و نقطه انجماد متانول و مقایسه آن با اتانول

مقدمه
متانول و اتانول دو ترکیب آلی بسیار نزدیک به هم از خانواده الکل ها هستند. هر دو از الکل های کوچک و ساده اند که برخی شباهت ها دارند اما از لحاظ ویژگی های فیزیکی و کاربردها تفاوت های آشکاری نیز نشان می دهند. متانول که اغلب الکل چوب نامیده می شود (متیل الکل)، ساده ترین الکل است و تنها یک اتم کربن دارد، در حالی که اتانول که به اتیل الکل یا الکل غلات معروف است دارای دو اتم کربن در ساختار خود می باشد. هر دوی متانول و اتانول مایعات بی رنگ، فرار و قابل اشتعال در دمای محیط است. هر دو به دلیل گروه هیدروکسیل (OH) قطبی خود به راحتی در آب مخلوط می شوند. با وجود این شباهت ها، نقطه جوش و نقطه انجماد آن ها به طور قابل توجهی متفاوت است، که بر نحوه کار کردن و استفاده از هرکدام تأثیر می گذارد. برای مثال، اتانول همان نوع الکلی است که در نوشیدنی های الکلی یافت می شود و نیز به عنوان سوخت و حلال در صنایع مختلف به کار می رود، در حالی که متانول برای انسان بسیار سمی است و عمدتاً در کاربردهای صنعتی مانند حلال ها، عوامل ضدیخ و به عنوان ماده اولیه در سنتزهای شیمیایی استفاده می شود. در صنایع کشور، یکی از رایج ترین مسیرهای تأمین این ماده، خرید حواله متانول کارون است که به دلیل کیفیت مناسب و دسترسی پایدار، در بسیاری از واحدهای صنعتی مورد توجه قرار می گیرد و این موضوع اهمیت شناخت تفاوت های رفتاری متانول و اتانول از جمله نقطه جوش و انجماد را بیشتر می کند. در مجموع درک ویژگی های بنیادی این دو الکل پایه ای را فراهم می کند تا بتوان تفاوت های نقطه جوش و نقطه انجماد آن ها را عمیق تر بررسی کرد.
متانول و اتانول: آشنایی با مفاهیم پایه
متانول (CH3OH) و اتانول (C2H5OH) دو ترکیب آلی بسیار نزدیک به هم از خانواده الکل ها هستند. هر دو از الکل های کوچک و ساده اند که برخی شباهت ها دارند اما از لحاظ ویژگی های فیزیکی و کاربردها تفاوت های آشکاری نیز نشان می دهند. متانول که اغلب الکل چوب نامیده می شود (متیل الکل)، ساده ترین الکل با یک اتم کربن است، در حالی که اتانول که به اتیل الکل یا الکل غلات معروف است دارای دو اتم کربن در ساختار خود می باشد. هر دوی متانول و اتانول مایعات بی رنگ، فرّار و قابل اشتعال در دمای محیط است. هر دو به دلیل گروه هیدروکسیل قطبی خود به راحتی در آب مخلوط می شوند. با وجود این شباهت ها، نقطه جوش و نقطه انجماد آن ها به طور قابل توجهی متفاوت است، که بر نحوه کار کردن و استفاده از هرکدام تأثیر می گذارد. برای مثال، اتانول همان نوع الکلی است که در نوشیدنی های الکلی یافت می شود و نیز به عنوان سوخت و حلال در صنایع مختلف به کار می رود، در حالی که متانول برای انسان بسیار سمی است و عمدتاً در کاربردهای صنعتی مانند حلال ها، عوامل ضدیخ و به عنوان ماده اولیه در سنتزهای شیمیایی استفاده می شود. در مجموع، درک ویژگی های بنیادی این دو الکل پایه ای را فراهم می کند تا بتوان تفاوت های نقطه جوش و نقطه انجماد آن ها را عمیق تر بررسی کرد.
تفاوت در ساختار شیمیایی و ترکیب
تفاوت اصلی بین متانول و اتانول در ساختار مولکولی و ترکیب آن ها است. فرمول شیمیایی متانول CH3OH می باشد که نشان دهنده یک اتم کربن، چهار اتم هیدروژن و یک اتم اکسیژن است که به صورت یک گروه متیل متصل به یک گروه هیدروکسیل ترتیب یافته اند. فرمول اتانول C2H5OH (که اغلب به صورت CH3CH2OH نوشته می شود) است و نشان می دهد که دارای دو اتم کربن (یک زنجیر اتیل) متصل به یک گروه هیدروکسیل است. به عبارت دیگر، اتانول در مقایسه با متانول یک اتم کربن اضافی و دو اتم هیدروژن بیشتر دارد. هر یک از این الکل ها یک گروه عاملی OH دارند که آن ها را در دسته الکل های نوع اول قرار می دهد. افزایش جزئی در اندازه و وزن مولکولی از متانول به اتانول (جرم مولی ~۳۲ g/mol در برابر ~۴۶ g/mol منجر به تفاوت هایی در ویژگی های فیزیکی آن ها شده است. ساختار کوچک تر و قطبی تر متانول به آن قطبیت کمی بالاتر می دهد، در حالی که زنجیر کربنی بلندتر اتانول مقداری خاصیت آبگریز بیشتر وارد می کند. هر دو مولکول می توانند به دلیل گروه OH پیوند هیدروژنی تشکیل دهند، اما اتم کربن اضافی در اتانول بر میزان نزدیکی بسته بندی مولکول ها و قدرت نیروهای بین مولکولی آن تأثیر می گذارد. این تمایزات ساختاری پایه تفاوت های مشاهده شده در نقطه جوش و نقطه انجماد آن ها است.
ویژگی های فیزیکی متانول به طور خلاصه
متانول مایعی سبک، بی رنگ، بسیار فرّار و قابل اشتعال است. بوی اندکی شیرین و تند شبیه به اتانول دارد، هرچند بخارات متانول سمی تر می باشند. متانول به طور کامل در آب مخلوط می شود، به این معنی که به دلیل گروه هیدروکسیل قطبی اش می تواند به هر نسبتی با آب امتزاج یابد. از ویژگی های فیزیکی مهم متانول می توان به نقطه جوش نرمال حدود ۶۴٫۷ °C (۱۴۸٫۵ °F) در فشار اتمسفری استاندارد و نقطه انجماد (نقطه ذوب) حدود -۹۷٫۶ °C (-۱۴۳٫۷ °F) اشاره کرد. این مقادیر نشان می دهد که متانول در یک گستره دمایی وسیع به صورت مایع باقی می ماند، از دماهایی بسیار پایین تر از نقطه انجماد آب تا گرمایش معتدل. چگالی متانول در ۲۰ °C حدود ۰٫۷۹۱۸ g/cm³ است که کمی از آب کم تر است. افزون بر این چگالی و ویسکوزیته متانول در دماهای مختلف رفتار متفاوتی از خود نشان می دهند؛ به طوریکه با کاهش دما چگالی افزایش یافته و ویسکوزیته بیشتر می شود، و این تغییرات نقش مهمی در کاربردهای صنعتی، انتقال حرارت و عملکرد متانول در شرایط عملیاتی مختلف دارند.به بیان عملی، نقطه جوش پایین آن به این معنی است که متانول در دمای اتاق به سرعت تبخیر می شود، و نقطه انجماد بسیار پایین آن به این معنی است که تا زمانی که در معرض سرمای بسیار شدید قرار نگیرد جامد نمی شود. این ویژگی های فیزیکی متانول را به حلال صنعتی، جز ضدیخ و سوخت مفیدی تبدیل کرده اند. به عنوان مثال, متانول به شوینده های شیشه خودرو و محصولات یخ زدا اضافه می شود زیرا در دماهای زیر صفر مایع باقی می ماند، در حالی که آب یخ می زند. با این حال، قابلیت اشتعال پذیری و سمی بودن بالای آن به معنای لزوم احتیاط در کاربردهای آن است.
ویژگی های فیزیکی اتانول به طور خلاصه
اتانول یک مایع شفاف، بی رنگ و قابل اشتعال با بوی خاص الکل (که اغلب بویی خوشایند و شبیه عطر توصیف می شود) است. این مایع شدیداً فرّار است، اگرچه اندکی کم تر از متانول, و در هر نسبتی کاملاً با آب مخلوط می شود. نقطه جوش نرمال اتانول حدود ۷۸٫۴ °C (۱۷۳٫۱ °F) در فشار اتمسفری است که به طور قابل توجهی بالاتر از متانول می باشد و نشان دهنده فرّاریت کم تر آن است. نقطه انجماد (ذوب) آن حدود -۱۱۴٫۱ °C (-۱۷۳٫۴ °F) است که بسیار پایین تر (سردتر) از متانول است. این نقطه انجماد فوق العاده پایین به این معناست که اتانول تا دماهایی که بسیاری از مایعات دیگر جامد می شوند، مایع باقی می ماند برای مثال، اتانول خالص در یک فریزر معمولی خانگی (حدود -۲۰ °C) یخ نمی بندد. در محیط های آزمایشگاهی، از اتانول همراه با یخ خشک برای ایجاد حمام های بسیار سرد در حدود -۷۸ °C استفاده می شود بدون آنکه اتانول یخ بزند. چگالی اتانول در ۲۰ °C تقریباً ۰٫۷۸۹ g/cm³ است که از آب کم تر و اندکی از متانول نیز کم تر است. این ویژگی های فیزیکی، به همراه سمی بودن نسبتاً پایین تر اتانول در مقایسه با متانول، باعث شده که اتانول برای کاربردهایی از نوشیدنی های الکلی و اسانس های خوراکی گرفته تا استفاده به عنوان حلال و افزودنی سوختی تجدیدپذیر (مانند گازوالکل) ایده آل باشد.
نقطه جوش متانول و فراریت آن
متانول دارای نقطه جوش نسبتاً پایینی است، حدود ۶۴٫۷ °C (۱۴۸٫۵ °F) در فشار اتمسفری استاندارد. چنین دمای جوش پایینی، متانول را در دسته مایعات بسیار فرّار قرار می دهد. به بیان عملی، این به آن معنا است که متانول در دمای اتاق به راحتی تبخیر می شود. اگر ظرف بازی حاوی متانول را رها کنیم، مایع بسیار سریع تر از آب در همان شرایط ناپدید می شود. نقطه جوش متانول همچنین به طور قابل توجهی پایین تر از نقطه جوش اتانول (۷۸٫۴ °C) و آب (۱۰۰ °C) است که نشان دهنده نیروهای بین مولکولی نسبتاً ضعیف تری است که مولکول های متانول را در فاز مایع کنار هم نگه داشته اند. نقطه جوش متانول همچنین به فشار محیط بستگی دارند: در ارتفاعات بالاتر (فشار پایین تر) در دماهای حتی پایین تری می جوشد. فرّاریت بالای آن هم مزایا و هم مخاطراتی به همراه دارد. از یک سو، سهولت تبخیر آن متانول را به یک سوخت خوب (تشکیل بخاری که به راحتی مشتعل می شود) و ماده مفید در فرآیندهای صنعتی مانند حلال های خشک شونده سریع تبدیل می کند. در واقع، متانول به عنوان سوخت در موتورهای مسابقه ای با کارایی بالا و موتورهای مدل هواپیما استفاده شده است زیرا تبخیر سریع آن به اختلاط با هوا برای احتراق کارآمد کمک می کند. از سوی دیگر، بخارات متانول قابل اشتعال و سمی هستند، بنابراین تبخیر سریع می تواند در صورت تجمع بخارات در فضاهای غیرتهویه خطر آتش سوزی و آسیب سلامتی ایجاد کند.
نقطه جوش اتانول به صورت دقیق تر
اتانول در فشار اتمسفری نرمال در حدود ۷۸٫۴ °C (۱۷۳٫۱ °F) به جوش می آید که مقداری بین نقطه جوش پایین تر متانول و نقطه جوش بالاتر آب قرار دارد. این نقطه جوش متوسط به نقش اتانول به عنوان یک حلال چندمنظوره کمک می کند و امکان خالص سازی آن را به روش تقطیر فراهم می سازد. برای مثال، در تولید نوشیدنی های الکلی یا اتانول سوختی، یک محلول تخمیری (که عمدتاً از آب و اتانول تشکیل شده) را می توان تا حوالی دمای جوش اتانول گرم کرد: اتانول به طور ترجیحی تبخیر می شود و از آب جدا می گردد زیرا آب تا ۱۰۰ °C مایع باقی می ماند. با جمع آوری و سرد کردن این بخارات غنی از اتانول، تولیدکنندگان می توانند اتانول را از یک محلول رقیق تغلیظ کنند. به بیان روزمره، اتانول همچنان نسبتاً فرّار است برای مثال، اگر ظرف نوشیدنی الکلی بازی بماند، به مرور محتوای الکلی آن بر اثر تبخیر اتانول کاهش می یابد. با این حال، اتانول به دلیل نقطه جوش بالاتر و اندکی نیروهای بین مولکولی قوی تر نسبت به متانول، آهسته تر تبخیر می شود. در محیط های آزمایشگاهی, نقطه جوش اتانول آنقدر پایین است که می توان آن را به راحتی تبخیر یا جوشانده و حذف کرد (برای نمونه، با استفاده از دستگاه تقطیر چرخان جهت زدودن اتانول از یک نمونه)، و در عین حال آنقدر بالا است که در دمای محیط بدون بخارشن شدن بیش از حد به صورت مایع باقی بماند. در مجموع، رفتار جوشیدن اتانول یک توازن کاربردی را نشان می دهد که در بسیاری از فرایندهای صنعتی و آشپزی از آن بهره گرفته می شود.
چرا نقطه جوش اتانول از متانول بالاتر است
این واقعیت که اتانول در دمایی بالاتر از متانول به جوش می آید, را می توان با تفاوت نیروهای بین مولکولی و اندازه مولکولی آن ها توضیح داد. هر دوی مولکول های اتانول و متانول قادر به تشکیل پیوند هیدروژنی هستند زیرا گروه OH دارند، بنابراین هر یک از این الکل ها از این نوع نیروی بین مولکولی قوی بهره مند می شوند. با این حال، اتانول وزن مولکولی بالاتر و ساختار مولکولی بزرگ تری یک گروه CH2 اضافی نسبت به متانول دارند. اندازه بزرگ تر اتانول به معنای الکترون های بیشتر و سطح تماس بزرگ تر است که قدرت نیروهای پراکندگی لندن (جاذبه های ضعیفی که بر اثر دوقطبی های موقت در مولکول ها ایجاد می شوند) را افزایش می دهد. به بیانی، مولکول های اتانول نسبت به مولکول های متانول کمی چسبنده تر به یکدیگر هستند، فقط به این دلیل که فرصت بیشتری برای اثر این نیروهای واندروالسی بین خود دارند. متانول، به دلیل کوچک تر بودن، تا حدودی کمتر از این نیروهای پراکندگی بهره مند است، با وجود اینکه بسیار قطبی است. بنابراین، حتی با اینکه هر دو الکل پیوند هیدروژنی مشابهی برقرار می کنند، نیروهای پراکندگی اضافی در اتانول به آن برتری می دهد و نیاز به گرمای بیشتری (دمای بالاتر) برای شکستن مولکول ها و تبدیل به بخار دارد. این همان دلیلی است که نقطه جوش اتانول حدود ۱۳ °C بالاتر از متانول می باشد.
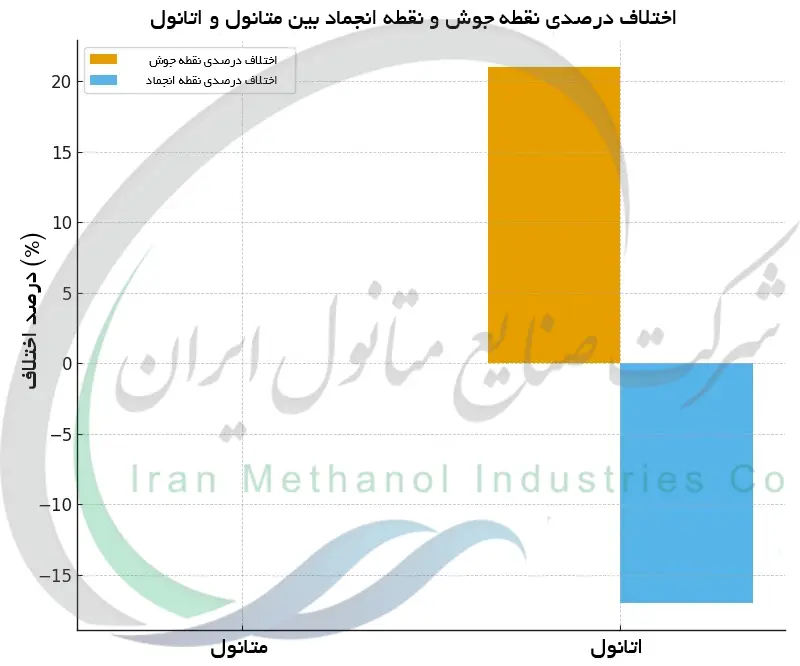
نقطه انجماد متانول و رفتار آن در دماهای پایین
متانول خالص دارای نقطه انجماد بسیار پایینی در حدود -۹۷٫۶ °C (-۱۴۳٫۷ °F) است. این بدان معنی است که در فشار استاندارد, متانول تا زمانی مایع باقی می ماند که دمای محیط تقریباً به -۹۸ °C نرسد و در آن دما جامد می شود (منجمد می گردد). چنین نیاز به دمای فوق العاده پایینی برای انجماد، بسیار پایین تر از هر شرایط آب و هوایی معمول روی زمین است. در عمل، این امر نشان می دهد که متانول می تواند در محیط هایی بسیار سردتر از سردترین اقلیم های طبیعی نیز به صورت مایع باقی بماند. حتی در مناطق قطبی یا شرایط زمستانی در ارتفاعات بالا که ممکن است دما تا -۵۰ °C یا -۶۰ °C سقوط کند، متانول باز هم یخ نمی زند. تنها زمان هایی که ممکن است با متانول جامد مواجه شویم در آزمایشگاه های تخصصی است که دما به آن حدهای افراطی نزدیک می شود. هنگامی که یخ بزند، متانول بلورهای جامد تشکیل می دهد، اما این امر خارج از محیط های کنترل شده به ندرت مشاهده می شود. نقطه انجماد بسیار پایین یکی از دلایلی است که متانول را به یک عامل ضدیخ ارزشمند تبدیل کرده است: متانول نقطه انجماد آب را در محلول ها به میزان زیادی کاهش می دهد و محلول ها را در دماهای زیر صفر مایع نگه می دارد. برای مثال، در سیالات ضدیخ خودرو و هوانوردی، متانول با مقاومت در برابر انجماد خود مانع شکل گیری یخ می شود. در کل، رفتار متانول در دماهای پایین با باقی ماندن در حالت مایع در شرایطی که بسیاری از مایعات دیگر از حرکت بازمی مانند مشخص می شود.
نقطه انجماد اتانول و رفتار آن در دماهای پایین
نقطه انجماد اتانول تقریباً -۱۱۴٫۱ °C (-۱۷۳٫۴ °F) است که حتی پایین تر از متانول می باشد. به عبارت دیگر، اتانول خالص تا زمانی که دما به زیر -۱۱۴ °C نرسد به صورت مایع باقی می ماند که این آستانه دمایی در عمل فوق العاده پایین است. این امر توضیح می دهد چرا بطری های ودکا یا دیگر نوشیدنی های الکلی با درجه الکل بالا در یک فریزر معمولی خانگی (حدود -۱۵ °C تا -۲۰ °C) یخ نمی زنند فریزر به هیچ وجه به اندازه کافی سرد نیست. در واقع، هیچ دمای طبیعی بیرونی بر روی زمین، حتی در سردترین زمستان های جنوبگان، به -۱۱۴ °C نمی رسد؛ اتانول فقط در شرایط مصنوعی بسیار سردتر می تواند به طور جامد درآید. برای مثال، اتانول را می توان با استفاده از خنک سازی با نیتروژن مایع (حدود -۱۹۶ °C) جامد کرد که در آن دما به صورت جامد متبلور می شود. در اغلب شرایطی که با آن روبرو هستیم، با این حال، اتانول عملاً یخ نمی زند؛ در حتی محیط های فوق العاده سرد نیز به صورت مایع جاری باقی می ماند. از این ویژگی در راه های مختلف بهره برداری می شود: در حمام های سرمایشی آزمایشگاهی (با استفاده از یخ خشک در -۷۸ °C) از این که اتانول در آن دما مایع باقی می ماند استفاده می کنند، و روش های تغلیظ از طریق انجماد در تهیه نوشیدنی ها نیز متکی بر این است که اتانول مایع باقی می ماند در حالی که آب موجود یخ می زند. به طور کلی، رفتار اتانول در دماهای پایین با مقاومت استثنایی در برابر انجماد مشخص می شود که به آن امکان می دهد در جایی مایع بماند که بسیاری از مواد دیگر مدت ها پیش جامد شده اند.
چرا نقطه انجماد اتانول از متانول پایین تر است
شاید در نگاه اول عجیب به نظر برسد که اتانول با وجود داشتن نقطه جوش بالاتر، در دمای پایین تری نسبت به متانول منجمد می شود. دلیل این امر به نحوه رفتار مولکول های آن ها در تشکیل جامد بازمی گردد. انجماد مستلزم آن است که مولکول ها کند شوند و در یک شبکه بلوری منظم قرار گیرند. در متانول، مولکول های کوچک و شدیداً قطبی می توانند یک شبکه مرتبط با پیوندهای هیدروژنی قوی در فاز جامد تشکیل دهند. مولکول های متانول به نسبت آسانی با جاذبه های بین مولکولی قوی کنار هم جفت می شوند و بنابراین در دمای گرم تری (البته هنوز بسیار سرد، -۹۷٫۶ °C) شروع به بلورین شدن (یخ زدن) می کنند. اتانول، در مقابل، یک اتم کربن اضافی دارد و کمی کم تر قطبی است؛ مولکول های آن حجیم تر بوده و به اندازه متانول تمایلی به قفل شدن در کنار یکدیگر ندارند. گروه اتیل در اتانول مانع می شود که مولکول ها به صورت فشرده و با پیوندهای هیدروژنی قوی در یک ساختار جامد کنار هم بنشینند. در نتیجه، اتانول تا دمای بسیار پایین تری مایع نامنظم باقی می ماند تا این که سرما آن را وادار کند مولکول هایش را در یک آرایش سخت به هم قفل کند. اساساً، مولکول های اتانول نسبت به متانول اندکی نیروی بین مولکولی مؤثر ضعیف تری برای جامد شدن تجربه می کنند و بنابراین محیط سردتری (حدود -۱۱۴ °C) نیاز است تا اتانول یخ بزند. بدین ترتیب، متانول می تواند آسان تر به حالت جامد درآید، در حالی که اتانول برای غلبه بر حرکات مولکولی و خصوصیات ساختاری اش به سرمای اضافی نیاز دارد و همین امر باعث شده نقطه انجماد آن پایین تر باشد.
نیروهای بین مولکولی: تأثیر بر نقطه جوش و انجماد
ویژگی های جوشیدن و یخ زدن متانول و اتانول عمدتاً توسط نیروهای بین مولکولی آن ها تعیین می شود. هر چه جاذبه بین مولکول ها قوی تر باشد، انرژی (دمای) بیشتری برای جدا کردن آن ها و تبدیل به گاز نیاز است (که به نقطه جوش بالاتری منجر می شود) و راحت تر در یک جامد کنار هم قرار می گیرند (که معمولاً نقطه ذوب/انجماد بالاتری را موجب می شود). هر دو متانول و اتانول پیوند هیدروژنی قابل توجه و برهم کنش دوقطبی-دوقطبی دارند (به لطف گروه های OH خود) که نقطه جوش آن ها را نسبت به مولکول های ناقطبی با اندازه مشابه نسبتاً بالا نگه داشته است. برای مثال، اتانول (C2H5OH) در حدود ۷۸ °C می جوشد، در حالی که اتان (C2H6)، یک مولکول ناقطبی با جرم مولی قابل مقایسه، در حدود -۸۹ °C به جوش می آید پیوندهای هیدروژنی و قطبیت اتانول باعث شده مایع آن بسیار سخت تر به بخار تبدیل شود. با این حال، عوامل متعددی در کارند. نیروهای پراکندگی لندن با افزایش اندازه مولکولی قوی تر می شوند و تا حدی توضیح می دهد که چرا نقطه جوش اتانول بالاتر از متانول است. در عین حال، شکل مولکولی و هندسه پیوندهای هیدروژنی نیز بر سهولت کنار هم قرار گرفتن مولکول ها در یک جامد اثر می گذارد. به همین دلیل، روندهای نقطه جوش و نقطه انجماد همیشه دقیقاً موازی هم پیش نمی روند. در اصل، پیوند هیدروژنی و سایر نیروهای بین مولکولی عوامل تعیین کننده رفتار جوشیدن و انجماد هستند، اما اندازه و ساختار مولکولی می توانند اثر آن ها را بر هر یک از این تغییر فازها به شکل متفاوتی تعدیل کنند.
نتیجه گیری: مقایسه ویژگی های دمایی متانول و اتانول
متانول و اتانول به عنوان الکل هایی که رابطه نزدیکی با هم دارند نشان می دهند چگونه یک تفاوت کوچک در ساختار مولکولی می تواند به ویژگی های فیزیکی متمایزی منجر شود. متانول (CH3OH) در حدود ۶۴٫۷ °C به جوش می آید و در تقریباً -۹۷٫۶ °C منجمد می شود، در حالی که اتانول (C2H5OH) در حدود ۷۸٫۴ °C می جوشد و نزدیک به -۱۱۴٫۱ °C منجمد می شود. به طور خلاصه، نقطه جوش اتانول بالاتر از متانول است، اما نقطه انجماد آن پایین تر می باشد که نتیجه تعامل بین اندازه مولکولی، نیروهای بین مولکولی و نحوه بسته بندی ساختاری آن ها است. این تفاوت ها فراتر از اعداد صرف هستند: آن ها به پیامدهای عملی در صنعت، آزمایشگاه و زندگی روزمره تبدیل می شوند. از نحوه تقطیر مشروبات الکلی یا تهیه محلول های ضدیخ گرفته تا ملاحظات ایمنی در حمل و نگهداری، ویژگی های مربوط به نقطه جوش و انجماد متانول و اتانول کاربرد آن ها را جهت دهی می کند. فهم این ویژگی ها روشن می سازد که چرا هر کدام برای نقش های معینی مناسب است متانول به عنوان حلال و سوخت با تبخیر سریع و مقاومت در برابر سرما (هرچند بسیار سمی)، و اتانول به عنوان الکلی با فرّاریت کمی کمتر و سمیت کمتر که برای نوشیدنی ها، عصاره ها و بسیاری فرآیندهای شیمیایی ایده آل است. هر دوی این مواد بر این اصل بنیادی تأکید دارند که ساختار مولکولی و نیروهای بین مولکولی یک ماده به طور مستقیم رفتار آن در تغییر حالت ها را شکل می دهد، و این امر بر نحوه بهره گیری ما از آن ماده در دنیای واقعی تأثیر می گذارد.
| ویژگی | متانول (CH3OH) | اتانول (C2H5OH) | واحدها | توضیحات |
|---|---|---|---|---|
| فرمول شیمیایی | CH3OH | C2H5OH | – | ساده ترین الکل (یک کربن) در مقابل الکل دارای دو کربن |
| جرم مولی | ۳۲٫۰۴ | ۴۶٫۰۷ | گرم/مول | اتانول حدود ۱۴ گرم مول سنگین تر است |
| نقطه جوش (در ۱ اتمسفر) | ۶۴٫۷ | ۷۸٫۴ | °C | نقطه جوش نرمال اتانول بالاتر است |
| نقطه انجماد (ذوب) | -۹۷٫۶ | -۱۱۴٫۱ | °C | نقطه انجماد اتانول پایین تر است |
| چگالی (در ۲۰°C) | ۰٫۷۹۱۸ | ۰٫۷۸۹ | g/cm³ | بسیار نزدیک (متانول اندکی متراکم تر است) |
| ثابت دی الکتریک (۲۰°C) | ~۳۳ | ~۲۵ | – | متانول قطبی تر است (گذردهی بالاتر) |
| نقطه اشتعال | ~۱۱ | ~۱۳ | °C | هر دو بسیار اشتعال پذیرند (نقطه اشتعال پایین) |




