فهرست عناوین
- مقدمه
- متانول: خواص و ویژگی ها
- تولید صنعتی متانول
- مواد اولیه و گاز سنتز در تولید متانول
- کاتالیست های مورد استفاده در سنتز متانول
- متانول به عنوان سوخت برای موتورهای احتراقی
- سلول سوختی مستقیم متانولی (DMFC)
- متانول به عنوان خوراک شیمیایی و حلال
- تولید فرمالدهید از متانول
- اسید استیک از متانول (فرآیند کربونیلاسیون)
- فرآیندهای متانول به اولفین (MTO) و متانول به بنزین (MTG)
- تولید دی متیل اتر (DME) از متانول
- متیل ترت بوتیل اتر (MTBE) و سایر افزودنی های سوخت از متانول
- تولید بیودیزل با استفاده از متانول
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 29-07-1404
تاریخ بروزرسانی مقاله : 29-07-1404
تعداد کلمات : 3900
آدرس مقاله : لینک مقاله
اصطلاحات فنی مرتبط با متانول

مقدمه
متانول که به عنوان الکل متیلیک یا الکل چوب نیز شناخته می شود، یک ماده شیمیایی ساده اما فوق العاده متنوع با اهمیت صنعتی بالا است. این کوچک ترین مولکول الکل با فرمول CH₃OH بوده و به شکل مایعی شفاف و بی رنگ وجود دارد. متانول به عنوان سوخت، حلال و ماده پایه شیمیایی در بخش های مختلف کاربردهای فراوانی دارد. در صنعت متانول، واحدها و مقیاس ها در صنعت متانول (تن، بشکه، گالن) نقش بسیار مهمی در سنجش، ذخیره سازی و تجارت این ماده دارند؛ چرا که متانول معمولاً در مقادیر بسیار بالا تولید و جابهجا می شود و آگاهی از این واحدها برای معاملات بین المللی و محاسبات فنی ضروری است. این مقاله یک دید کلی جامع از اصطلاحات و مفاهیم فنی مرتبط با متانول ارائه می دهند از فرآیندهای تولید و خواص شیمیایی آن گرفته تا کاربردها، مشتقات و ملاحظات ایمنی مربوط به این ماده. با بررسی این مباحث، خوانندگان می توانند پی ببرند که متانول در صنایع انرژی و شیمیایی تا چه اندازه اهمیت دارد.
متانول: خواص و ویژگی ها
مـتـانـول سـاده تـریـن الـکـل اسـت کـه از یـک اتـم کـربـن مـتـصـل بـه سـه اتـم هـیـدروژن و یـک گـروه هـیـدروکـسـیـل (CH₃OH) تـشـکـیـل شـده اسـت. ایـن مـایـع در دمـای اتـاق قـطـبـی، بـی رنگ و فـرار بـوده و بـوی الـکـل مـانـنـد مـشـخـصـی دارد. از خـواص فـیـزیـکـی مـهـم مـتـانـول مـی تـوان بـه نـقـطـه جـوش حـدود ۶۴٫۷ درجـه سـانـتـی گـراد و نـقـطـه انـجمـاد نـزدیـک بـه مـنـفـی ۹۴ درجـه اشـاره کـرد. مـتـانـول در آب و بـسـیـاری از حـلال هـای آلـی بـه طـور کـامـل مـخـلـوط مـی شـود و خـود بـه عـنـوان یـک حـلال نـیـز مـفـیـد اسـت. در صـنـایـع شـیـمـیـایـی و پـتـروشـیـمـی، مـتـانـول مـاده ای پـایـه ای بـرای تـولـیـد انـواع سـوخـت هـا، رزیـن هـا و حـلال هـا مـحـسـوب مـی شـود و در پـروژه هـای بـزرگ صـنـعـتـی از جـمـلـه خـریـد مـتـانـول تـهـران مـخـزن IBC بـه عـنـوان یـک روش مـتـداول تـامـیـن و حـمـل ایـن مـاده اسـتـفـاده مـی شـود، زیـرا ایـن نـوع بـسـتـه بـنـدی ایـمـن، اسـتـانـدارد و مـنـاسـب بـرای جـابـجـایـی حـجـم بـالا از مـتـانـول اسـت. مـتـانـول بـه آسـانـی در هـوا مـی سـوزد و دی اکـسـیـد کـربـن و آب تـولـیـد مـی کـنـد، امـا شـعـلـه آن در روشـنـایـی روز تـقـریـبـاً نـامـرئـی و آبـی رنگ اسـت. ایـن مـاده بـه طـور تـاریـخـی از تـقـطـیـر مـخـرب چـوب بـه دسـت مـی آمـد و بـه هـمـیـن دلیـل الـکـل چـوب نـام گـرفـت. مـتـانـول امـروزی بـا خـلـوص بـالا و بـه روش صـنـعـتـی تـولـیـد مـی شـود، امـا هـمـچـنـان بـرای انـسـان شـدیـداً سـمـی اسـت؛ حـتـی مـقـدار کـمـی مـصـرف مـتـانـول مـی تـوانـد بـاعـث کـوری یـا مـرگ شـود زیـرا در بـدن بـه اسـیـد فـرمـیـک مـتـابـولـیـزه مـی شـود. ایـن ویـژگـی هـا رفـتـار مـتـانـول در مـحـیـط هـای آزمـایـشـگـاهـی و صـنـعـتـی را تـعـیـیـن مـی کـنـنـد. چـگـالـی مـتـانـول حـدود ۰٫۷۹ گـرم بـر سـانـتـی مـتـر مـکـعـب (کـمـتـر از آب) اسـت و بـسـیـار اشـتـعـال پـذیـر مـی بـاشـد، بـه طـوری کـه نـقـطـه اشـتـعـال آن حـدود ۱۱ درجـه سـانـتـی گـراد بـوده و در دمـاهـای نـسـبـتـاً پـایـیـن مـی تـوانـد بـخـارات آتـش گـیـر ایـجـاد کـنـد.
تولید صنعتی متانول
تولید صنعتی متانول معمولاً با سنتز شیمیایی از گازهای ساده انجام می شود. فرآیند اصلی شامل واکنش مونوکسید کربن (CO) با هیدروژن (H₂) تحت فشار و دمای بالا در حضور یک کاتالیست است. این مخلوط گازی CO و H₂ که گاز سنتز نام دارد، معمولاً از گاز طبیعی از طریق ریفورمینگ با بخار یا از زغال سنگ از طریق گازی سازی به دست می آید. در راکتور سنتز متانول، گاز سنتز در یک واکنش گرمازا به متانول (CH₃OH) تبدیل می شود: CO + 2H₂ → CH₃OH .کارخانجات مدرن در فشارهایی حدود ۵۰–۱۰۰ بار و دمای حدود ۲۰۰–۳۰۰°C عمل می کنند و از کاتالیست های پیشرفته استفاده می کنند که امکان تبدیل کارآمد را فراهم می سازد. کاتالیست های پایه مس به طور گسترده به کار می روند زیرا تولید متانول را در فشارهای پایین تر نسبت به فرآیندهای قدیمی پرفشار ممکن می سازند. نتیجه این فرآیند متانول خام است که سپس برای دستیابی به خلوص بالا تقطیر می شود. تولید صنعتی متانول از اواسط قرن بیستم رشد چشمگیری داشته و خوراک صنایع شیمیایی و سوخت را در سراسر جهان تأمین می کند. انعطاف پذیر بودن در انتخاب خوراک اولیه از گاز طبیعی تا زغال سنگ یا زیست توده بدان معناست که متانول را می توان هر کجا که منبع کربن و هیدروژن موجود باشد تولید کرد و این ماده به یک کالای مهم جهانی تبدیل شده است.
مواد اولیه و گاز سنتز در تولید متانول
مواد اولیه مبتنی بر کربن گوناگونی برای تولید گاز سنتز مورد نیاز سنتز متانول قابل استفاده هستند. گاز طبیعی (متان) متداول ترین خوراک است زیرا دارای هیدروژن بالایی است و فرایند ریفورمینگ کارایی بالایی دارد. در ریفورمینگ با بخار، متان با بخار آب واکنش داده و گاز سنتزی شامل هیدروژن، مونوکسید کربن و مقداری دی اکسید کربن تولید می کند. زغال سنگ نیز خوراک عمده دیگری است؛ با گازی سازی زغال سنگ در دمای بالا می توان مخلوط CO و H₂ به دست آورد البته گاز سنتز حاصل نیاز به تنظیم نسبت H₂/CO دارد. زیست توده و زباله های آلی نیز از طریق فرایند گازی سازی به گاز سنتز تبدیل می شوند که امکان تولید متانول زیستی یا تجدید پذیر را فراهم می کند. علاوه بر این، دی اکسید کربن بازیافت شده (مثلاً از دودکش های صنعتی یا هوا) می تواند به عنوان منبع کربن برای متانول عمل کند، به طوری که CO₂ با هیدروژن پاک واکنش داده و متانول سبز با ردپای کربن بسیار پایین تولید شود. هر خوراک ترکیب متفاوتی از گاز سنتز ایجاد می کند، بنابراین برای رسیدن به نسبت بهینه گازها جهت سنتز متانول تنظیماتی انجام می گیرد مثلاً افزودن هیدروژن اضافی یا گردش مجدد CO₂ تا نسبت مورد نظر حاصل شود. انعطاف پذیر بودن تولید متانول در استفاده از خوراک های متنوع نشان می دهد که این سوخت هم در صنعت پتروشیمی متداول و هم در حوزه انرژی پایدار پتانسیل بالایی دارد.
کاتالیست های مورد استفاده در سنتز متانول
کاتالیست ها در سنتز متانول نقش بسیار مهمی ایفا می کند زیرا امکان انجام واکنش کارآمد CO و H₂ را در دماها و فشارهای پایین تر فراهم می سازند. فرآیند صنعتی اولیه متانول (در دهه 1920) از کاتالیست اکسید روی/اکسید کروم استفاده می کرد اما مستلزم فشار بسیار بالا (حدود ۲۵۰–۳۰۰ اتمسفر) و دمای تقریباً ۳۵۰°C بود. امروزه از فرمولاسیون های پیشرفته تر، عمدتاً بر پایه مس به همراه اکسید روی و آلومینا (Cu/ZnO/Al₂O₃)، استفاده می شود. این کاتالیست های پایه مس بسیار فعال و انتخاب پذیر هستند و تولید متانول را در فشارهای پایین تر (۵۰–۱۰۰ اتمسفر) و حدود ۲۵۰°C امکان پذیر می کنند. مس به عنوان فلز فعال، سایت های مؤثری برای هیدروژنه کردن مونوکسید کربن و دی اکسید کربن به متانول فراهم می کند، در حالی که اکسید روی و آلومینا نقش پروموتر ساختاری را داشته و به توزیع مس و بهبود پایداری کاتالیست کمک می کنند. حذف گوگرد و سایر سموم از گاز سنتز بسیار مهم است، زیرا این ناخالصی ها می توانند کاتالیست را به سرعت غیرفعال کنند. با گذشت زمان، فعالیت کاتالیست ها به تدریج کاهش یافته و باید احیا یا تعویض شوند، بنابراین پژوهش ها بر بهبود عمر کاتالیست و یافتن کاتالیست های جدید (از جمله موادی با پالادیم، سریم یا حامل های نو) متمرکز شده است که بتوانند خوراک غنی از CO₂ را مؤثرتر تبدیل کنند. انتخاب و بهینه سازی کاتالیست یکی از جنبه های فنی کلیدی در تولید متانول است و مستقیماً بر راندمان و هزینه ها اثر دارد.
متانول به عنوان سوخت برای موتورهای احتراقی
متانول می تواند به عنوان یک سوخت جایگزین در موتورهای درون سوز، به ویژه موتورهای اشتعال جرقه ای (نوع بنزینی) استفاده شود. متانول عدد اکتان بسیار بالایی دارد و با شعله ای خنک تر می سوزند که اجازه می دهد موتور با نسبت تراکم بالاتر کار کند و توان بیشتری تولید نماید. سوخت متانول خالص گاهی M100 نامیده می شود و سوخت های ترکیبی بنزین - متانول مانند M15 یا M85 که به ترتیب دارای ۱۵ درصد و ۸۵ درصد متانول هستند در کاربردهای مختلف آزموده شده اند. در مسابقات حرفه ای، سوخت متانول محبوب بوده است برای مثال خودروهای ایندی 500 به مدت چند دهه با متانول کار می کردند زیرا عملکرد عالی و مزایای ایمنی را فراهم می کرد. شعله متانول کمتر احتمال دارد آتش سوزی فاجعه باری ایجاد کند (و می توان آن را با آب خاموش کرد)، هرچند دیدن این شعله دشوار است. اما در مقایسه با بنزین، انرژی متانول در هر لیتر تنها حدود نصف است، یعنی خودرو نیاز به باک بزرگ تر یا سوخت گیری مکرر برای طی مسافت مشابه دارد. متانول همچنین برای برخی فلزات خورنده است و می تواند اجزای لاستیکی یا پلاستیکی را تجزیه کند، بنابراین سامانه های سوخت باید با مواد مقاوم و افزودنی های ضد خوردگی اصلاح شوند. علی رغم این چالش ها، سوخت متانول آلایندگی کمتری تولید می کند و تقریباً بدون دوده می سوزد و مقادیر کمتری مونوکسید کربن، اکسیدهای نیتروژن و سایر آلاینده ها تولید می شود. برخی مناطق مانند چین مخلوط های متانول - بنزین را در مقیاس گسترده به کار گرفته اند و حتی خودروهای انعطاف پذیر نسبت به سوخت متانول (flex-fuel) طراحی کرده اند. در کل متانول یک سوخت با عدد اکتان بالا و تمیز محسوب می شود که در صورت اعمال تغییرات لازم در موتور می تواند جایگزین سوخت های متداول در برخی کاربردها شود و مسیری به سوی سوخت های تجدید پذیر آینده ارائه دهد.
| مشخصه | متانول | اتانول | بنزین | گازوئیل |
|---|---|---|---|---|
| فرمول شیمیایی | CH₃OH | C₂H₅OH | هیدروکربن های C4 تا C12 (مخلوط) | هیدروکربن های C10 تا C20 (مخلوط) |
| منبع تولید | سنتز از گاز سنتز (گاز طبیعی یا زغال سنگ) | تخمیر زیست توده | حاصل از پالایش نفت خام | حاصل از پالایش نفت خام |
| نقطه جوش (°C) | ۶۴٫۷ | ۷۸ | حدود ۳۰ تا ۲۰۰ | حدود ۱۵۰ تا ۳۷۰ |
| محتوای انرژی (مگاژول/لیتر) | حدود ۱۶ | حدود ۲۱ | حدود ۳۲ | حدود ۳۶ |
| عدد اکتان / ستان | حدود ۱۰۷ (اکتان) | حدود ۱۰۸ (اکتان) | ۹۰–۹۵ (اکتان) | حدود ۵۰ (ستان) |
| سمیت (در صورت بلع) | بسیار سمی (کوری/مرگ) | کم (الکل آشامیدنی) | بسیار سمی (ترکیبات سرطان زا) | سمی (مضر در صورت بلع) |
| کاربرد به عنوان سوخت | خودروهای مسابقه ای، خودروهای انعطاف پذیر سوخت | مخلوط در بنزین (مثل E10، E85) | سوخت اصلی خودروهای بنزینی | سوخت اصلی موتورهای دیزلی |
سلول سوختی مستقیم متانولی (DMFC)
علاوه بر موتورهای درون سوز، متانول می تواند به طور مستقیم در نوعی پیل سوختی برای تولید برق به کار رود. سلول سوختی مستقیم متانولی Direct Methanol Fuel Cell یا DMFC زیر مجموعه ای از پیل های سوختی غشای تبادل پروتون است که در آن متانول بدون نیاز به تبدیل به هیدروژن، مستقیماً به عنوان سوخت استفاده می شود. در DMFC، متانول (معمولاً در محلول آبی رقیق) به آند وارد شده و در آنجا طی واکنش الکتروشیمیایی به دی اکسید کربن، پروتون و الکترون تبدیل می شود. پروتون ها از طریق غشای پلیمری ویژه به سمت کاتد حرکت می کنند، در حالی که الکترون ها در مدار خارجی جریان یافته و جریان الکتریکی ایجاد می کنند. در کاتد، اکسیژن هوا با پروتون ها و الکترون های رسیده ترکیب شده و آب را به عنوان تنها محصول فرعی دیگر تولید می کند. DMFC ها در دماهای نسبتاً پایین حدود ۵۰ تا ۹۰°C کار می کنند که اجازه می دهد از مواد ساده و ارزان استفاده شده و پیل سریع راه اندازی شود. مزیت اصلی آن ها سهولت حمل و نقل متانول مایع است که سوختی پرانرژی و نسبتاً پایدار در شرایط محیطی است. با این حال DMFC ها با چالش هایی روبه رو هستند؛ بازده تبدیل انرژی آن ها در عمل تنها حدود ۳۰–۴۰٪ است و پدیده ای به نام عبور متانول (methanol crossover) بهره وری را کاهش می دهد، زیرا مقداری متانول از غشا عبور کرده و بدون واکنش مستقیم به کاتد می رسد. عبور متانول باعث کاهش ولتاژ و هدررفت سوخت می شود. برای رفع این مشکلات، تحقیقات گسترده ای در حال انجام است از توسعه غشاهای جدید و بهبود لایه های کاتالیست گرفته تا طراحی بهتر سیستم جریان سوخت تا کارایی عملی این پیل ها افزایش یابد. محصولات خروجی این سلول ها تنها دی اکسید کربن و آب هستند. در حال حاضر توان تولیدی DMFC ها محدود است، اما آن ها می توانند انرژی زیادی را در حجم کوچکی ذخیره کنند. این بدان معناست که می توانند مقدار کمی توان را در مدت طولانی تأمین کنند. در نتیجه برای به حرکت درآوردن وسایل نقلیه بزرگ مناسب نیستند، اما برای ابزارهای کوچکی مانند لیفتراک های انبار، تجهیزات الکترونیکی همراه (تلفن همراه، دوربین یا لپ تاپ) و همچنین مصارف نظامی که نیاز به توان بی صدا و بدون حرارت زیاد دارند ایده آل هستند. با پیشرفت بیشتر، یک نسخه کارآمدتر از این سلول ها می تواند در استفاده کلی از متانول به عنوان حامل انرژی نقشی کلیدی داشته باشد و تحقق مفهوم اقتصاد متانول را تسریع کند.
متانول به عنوان خوراک شیمیایی و حلال
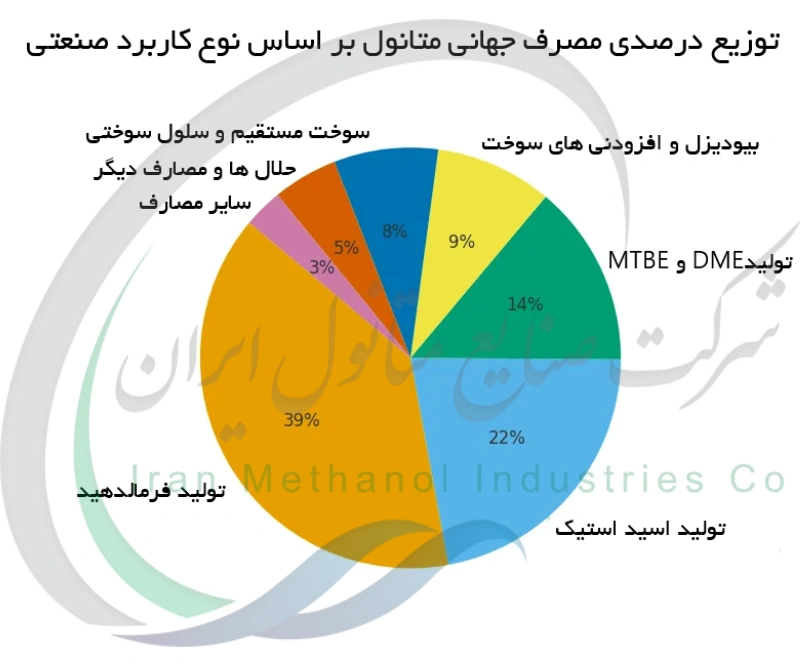
یکی از مهم ترین نقش های متانول خوراک بودن در صنعت شیمیایی است به عنوان ماده اولیه تولید طیف وسیعی از مواد دیگر. در واقع حدود ۴۰ درصد از متانول تولیدی جهان به فرمالدهید تبدیل می شود که سپس برای ساخت پلاستیک ها، رزین ها, چسب ها و پوشش های مصنوعی استفاده می شود. متانول همچنین با کربونیلاسیون (واکنش با مونوکسید کربن) به اسید استیک تبدیل می شود که آن هم یک ماده پرمصرف در تولید پلیمرها و حلال ها است. افزون بر این متانول می تواند به بی شمار مشتق دیگر تبدیل شود: در واکنش با ایزوبوتن متیل ترت بوتیل اتر (MTBE) تولید می کند که یک افزودنی معروف برای بهبود عدد اکتان بنزین است؛ با آب گیری (دهیدراته شدن)، متانول به دی متیل اتر (DME) تبدیل می شود که گازی مورد استفاده به عنوان پیشران در اسپری ها و سوخت جایگزین گازوئیل است؛ و همچنین متانول در ساخت ترکیبات دیگری مثل متیل آمین ها، متیل متاکریلات و بسیاری محصولات دیگر مشارکت دارد. این انعطاف پذیر بودن، متانول را به یکی از پایه های صنعت پتروشیمی تبدیل کرده است. گذشته از خوراک بودن، خود متانول نیز مستقیماً به عنوان حلال در آزمایشگاه ها و صنایع به کار می رود چون قطبی بوده و می تواند بسیاری از مواد را حل کند. متانول در رنگ ها، جوهرها و صنایع دارویی به عنوان محیط واکنش یا عامل پاک کننده مصرف می شود. متانول همچنین نقطه انجماد آب را کاهش می دهد و به همین دلیل در ترکیبات ضد یخ (مانند مایع شیشه شوی خودرو و جلوگیری از یخ زدگی خطوط لوله) مورد استفاده قرار می گیرد.
تولید فرمالدهید از متانول
فرمالدهید یکی مهم ترین مواد شیمیایی مشتق شده از متانول است. اصطلاح فنی برای این فرآیند اکسایش جزئی متانول است؛ طی این واکنش، متانول هیدروژن زدایی شده و به طور جزئی اکسید می شود تا فرمالدهید (CH₂O) تولید گردد. در صنعت، این واکنش با عبور بخار متانول آمیخته با هوا از روی یک کاتالیست اکسید فلزی (اغلب نقره یا اکسیدهای آهن و مولیبدن) در دمای بالا انجام می گیرد. فرمالدهید گازی در دمای محیط است اما معمولاً در آب جذب و به صورت محلول آبی (فرمالین) جمع آوری می شود تا استفاده از آن آسان تر گردد. این ترکیب یک ماده پایه در بسیاری مواد است، مقادیر زیادی از فرمالدهید برای ساخت رزین های اوره - فرمالدهید و فنل - فرمالدهید مصرف می شود که به ترتیب به عنوان چسب در تخته های چند لا و نئوپان و به عنوان بست در فوم های صنعتی به کار می روند. فرمالدهید حاصل از متانول همچنین در تولید پلاستیک های مهندسی، پوشش های سطحی و فرآوری منسوجات (مانند پارچه های ضد چروک) به مصرف می رسد. با توجه به اینکه درصد بزرگی از متانول تولیدی صرف تولید فرمالدهید می شود، ارتقای راندمان کاتالیست و کنترل آلاینده ها در واحدهای فرمالدهید از مسائل فنی مهم به شمار می رود. فراموش نشود که فرمالدهید خود ماده ای سمی و سرطان زا است، بنابراین کار با آن در کارخانه ها نیازمند ایمنی بالا است. با این وجود، توان تبدیل متانول به فرمالدهید امکان تولید انبوه بسیاری از مواد مدرن را فراهم کرده است.
اسید استیک از متانول (فرآیند کربونیلاسیون)
اسید استیک (CH₃COOH) یکی دیگر از مواد شیمیایی مهم است که از متانول از طریق فرآیندی به نام کربونیلاسیون تولید می شود. در این روش، متانول با کربن مونوکسید (CO) در حضور یک کاتالیست ویژه ترکیب شده و اسید استیک تشکیل می دهد. مشهورترین روش صنعتی آن فرآیند مونسانتو (و نسخه جدیدتر آن فرآیند کاتیوا) است که از یک کاتالیست همگن مبتنی بر رودیوم یا ایریدیوم به همراه یک کمک ساز یدیدی استفاده می کند. در راکتور، متانول و CO در فشار نسبتاً بالا (حدود ۳۰–۶۰ اتمسفر) و دمای حدود ۱۵۰–۲۰۰°C واکنش داده و با گزینش پذیری عالی به اسید استیک تبدیل می شوند: CH₃OH + CO → CH₃COOH .سپس اسید استیک با تقطیر از محصولات جانبی جدا و خالص می شود. کربونیلاسیون متانول جایگزین اکثر روش های قدیمی تولید اسید استیک (مانند اکسایش استالدهید یا اکسایش بوتان) شده است، چرا که کارآمدتر بوده و از خوراک های ارزان و فراوان بهره می گیرد. اسید استیک حاصل یک ماده کلیدی برای تولید مونومر وینیل استات (جهت ساخت پلیمرهای وینیل)، انیدرید استیک، استات سلولز و انواع حلال ها و مواد شیمیایی دیگر است. فناوری کربونیلاسیون متانول بسیار بهینه شده و به عنوان یکی از موفقیت های بزرگ صنایع شیمیایی در اواخر قرن بیستم شناخته می شود. این فرآیند نمونه بارزی است که نشان می دهد چگونه یک الکل تک کربنه (متانول) را می توان در مقیاس انبوه به یک اسید آلی دو کربنه (اسید استیک) تبدیل کرد.
فرآیندهای متانول به اولفین (MTO) و متانول به بنزین (MTG)
متانول به صورت کاتالیستی قابل تبدیل به هیدروکربن ها است و بدین ترتیب مسیرهایی برای تولید سوخت و پلیمر از منابع غیر نفتی فراهم می کند. دو فرآیند مهم در این زمینه متانول به اولفین ها Methanol-to-Olefins یا MTO و متانول به بنزین Methanol-to-Gasoline یا MTG نام دارند. در فرآیند MTO، بخار متانول از روی یک کاتالیست زئولیتی مانند SAPO-34 یا ZSM-5 در دمای بالا عبور داده می شود. مولکول های متانول در طی واکنش های آب گیری و بازآرایی، سرانجام به اولفین های سبک عمدتاً اتیلن و پروپیلن تبدیل می شوند. این اولفین ها بلوک های سازنده اصلی برای پلاستیک های پلی اتیلن و پلی پروپیلن هستند. فناوری MTO به طور تجاری به ویژه در مناطقی مانند چین (که زغال سنگ فراوان است) به کار گرفته شده است تا محصولات پتروشیمی از متانول زغال سنگی به جای نفت خام تولید شوند. از سوی دیگر فرآیند MTG (که توسط شرکت موبیل در دهه 1970 توسعه یافت) متانول را روی یک کاتالیست زئولیتی دیگر تبدیل به مخلوطی از هیدروکربن های محدوده بنزین می کند. MTG در دهه 1980 در نیوزیلند در مقیاس بزرگ به نمایش گذاشته شد که طی آن متانول حاصل از گاز طبیعی به بنزینی تبدیل گردید که مستقیماً در خودروها قابل استفاده بود. هرچند MTG به طور گسترده به کار گرفته نشد چون پالایش نفت اغلب مقرون به صرفه تر بود، اما به عنوان یک دستاورد فنی بسیار قابل توجه باقی مانده است. این فرآیندهای تبدیل نشان می دهند که چگونه یک الکل ساده مانند متانول قابل تبدیل به مولکول های بزرگ تر هیدروکربنی است. به خصوص مسیر MTO مورد توجه کشورهایی است که متانول ارزان و فراوان در اختیار دارند و می خواهند از آن برای تولید مواد اولیه پلاستیک بدون اتکا به نفت استفاده کنند.
تولید دی متیل اتر (DME) از متانول
دی متیل اتر (DME) یک سوخت و ماده شیمیایی پرکاربرد است که می تواند مستقیماً از متانول تولید شود. از نظر ساختار، DME ساده ترین اتر با فرمول CH₃OCH₃ است؛ اساساً متشکل از دو گروه متیل متصل شده توسط یک اتم اکسیژن. در صنعت, DME را از طریق آب گیری متانول می سازند: ۲ CH₃OH → CH₃OCH₃ + H₂O . این واکنش روی یک کاتالیست اسیدی (مانند آلومینا یا زئولیت) در دمای بالا انجام می شود و گرمازا است. از آنجا که آب زدایی متانول واکنشی ساده و گرمازا است، تولید DME را می توان در یک واحد با تولید متانول ادغام کرد یا در واحدی جداگانه انجام داد. دی متیل اتر در شرایط عادی گاز است (نقطه جوش حدود منفی ۲۵ درجه سانتی گراد)، اما می توان آن را تحت فشار نسبتاً پایین به صورت مایع ذخیره کرد مشابه گاز مایع LPG . DME به عنوان یک پیشران سازگار با محیط زیست جایگزین کلروفلوئوروکربن ها در اسپری های آئروسل شده است. افزون بر این، DME می تواند به عنوان سوخت مورد استفاده قرار گیرد: عدد ستان بالایی (حدود ۵۵) دارد و هنگام سوختن ذرات و دوده بسیار کمی تولید می کند. در واقع DME را می توان با گاز LPG مخلوط کرده و به عنوان سوخت در گرمایش یا پخت و پز خانگی بهره گرفت و حتی می توان آن را مستقیماً به جای گازوئیل در موتورهای دیزل استفاده کرد. کشورهایی نظیر چین کاربری DME را به عنوان سوخت دیزل جایگزین در اتوبوس ها و کامیون ها مورد آزمایش قرار داده اند. در دی متیل اتر نمونه دیگری از انعطاف پذیر بودن متانول را مشاهده می کنیم، متانول را می توان به راحتی به یک سوخت پاک تبدیل کرد که شکاف بین سوخت های مایع و گازی را پر می کند.
متیل ترت بوتیل اتر (MTBE) و سایر افزودنی های سوخت از متانول
متانول ماده ای کلیدی در تولید برخی افزودنی های سوخت است که مهم ترین آن ها متیل ترت بوتیل اتر (MTBE) می باشد. MTBE از واکنش متانول با ایزوبوتیلن (یک آلکن چهار کربنی) در حضور یک کاتالیست اسیدی حاصل می شود. نتیجه این واکنش MTBE با فرمول C₅H₁₂O است که یک اتر بوده و به طور گسترده به عنوان افزاینده اکتان و ماده اکسیژن دار در بنزین به کار می رفت. افزودن MTBE به بنزین عدد اکتان آن را افزایش داده و به سوختن کامل تر آن کمک می کند و در نتیجه آلاینده هایی نظیر مونوکسید کربن در گازهای خروجی کاهش می یابد. در دهه 1990، MTBE حجم زیادی از متانول تولیدی دنیا را مصرف می کرد. اما استفاده از MTBE در بنزین در آمریکا و برخی کشورها کاهش یافت، چون مشخص شد که در اثر نشت از مخازن، آب های زیرزمینی را آلوده می سازد؛ از این رو قوانین سختگیرانه ای برای محدودیت آن تصویب شد. بسیاری از پالایشگران MTBE را با اتانول (به عنوان ماده افزودنی اکسیژن دار) جایگزین کرده اند. با این حال MTBE هنوز در بنزین بسیاری مناطق جهان استفاده می شود و یک محصول مهم تجاری باقی مانده است. افزون بر MTBE، متانول می تواند افزودنی های سوختی دیگری نیز تولید کند؛ مثلاً با ایزو آمیلین واکنش داده و TAME (ترتیو آمیل متیل اتر) ایجاد می کند، هرچند این ماده به اندازه MTBE رایج نیست. خود متانول نیز گاهی به میزان کم مستقیماً به بنزین افزوده می شود برای مثال در چین بنزین M15 رایج است یا در ساخت سوخت های امتزاجی دیگر به کار می رود. روند جاری صنعت سوخت بر بهبود عملکرد افزودنی ها در کنار حداقل سازی اثرات زیست محیطی متمرکز است. مشتقات متانولی مانند MTBE به خوبی نشانگر سودمندی متانول در بهبود کیفیت سوخت هستند، هرچند تجربه MTBE مسائل بالقوه زیست محیطی ناشی از افزودنی های شیمیایی را نیز برجسته ساخته است.
تولید بیودیزل با استفاده از متانول
متانول نقش اساسی در تولید بیودیزل دارد که یک سوخت تجدید پذیر جایگزین گازوئیل است. بیودیزل عمدتاً از استرهای متیل اسیدهای چرب تشکیل شده و طی واکنشی به نام ترانس استریفیکاسیون (تعویض استری) تولید می شود. در این فرآیند، تری گلیسریدها (مولکول های اصلی روغن های گیاهی یا چربی های جانوری) با متانول در حضور یک کاتالیزور بازی (معمولاً هیدروکسید سدیم یا پتاسیم) واکنش می کنند. در اثر این واکنش، متانول مولکول تری گلیسرید را شکسته و سه مولکول استر متیل (بیودیزل) و یک مولکول گلیسرول تولید می شود. متانول الکل ترجیحی برای این فرآیند است، زیرا ارزان و در دسترس بوده و به خوبی واکنش داده و استرهای متیلی ایجاد می کند که خواص سوختی مطلوب دارند. واکنش ترانس استریفیکاسیون در دمای متوسط حدود ۵۰–۶۰°C طی زمان کوتاهی انجام می شود و امکان تولید در مقیاس بزرگ صنعتی را دارد. پس از انجام واکنش، فاز سوخت بیودیزل از فاز گلیسرول جدا شده و سوخت برای حذف هرگونه متانول یا کاتالیزور باقیمانده تصفیه می گردد. نتیجه کار سوختی است که می توان در موتورهای دیزل استفاده کرد چه به صورت خالص B100 و چه به صورت مخلوط مثلاً B20. تولید بیودیزل، متانول قابل توجهی مصرف می کند؛ برای هر تن بیودیزل تقریباً ۱۰ درصد وزنی متانول لازم است. این مسیر تولید سوفت سبز برجسته کننده نقش متانول در انرژی پایدار است، متانول امکان تبدیل روغن های زیستی به یک سوخت مصرفی را فراهم می کند که به کاهش انتشار کربن و وابستگی به سوخت فسیلی کمک می کند.




