فهرست عناوین
- مقدمه
- متانول: ساختار شیمیایی و قطبیت
- اصول قطبیت و حلالیت (شبیه شبیه را در خود حل می کند)
- متانول به عنوان یک حلال قطبی پروتیک
- پیوند هیدروژنی بین متانول و آب
- متانول و آب: امتزاج پذیری کامل در همه نسبت ها
- مقایسه قطبیت متانول و آب
- حلالیت متانول در حلال های مختلف (قطبی و غیر قطبی)
- ماهیت دوگانه قطبی و غیر قطبی مولکول متانول
- تاثیر دما بر حلالیت متانول
- شاخص قطبیت و ثابت دی الکتریک متانول
- متانول در مقایسه با الکل های بالاتر: روند حلالیت در آب
- کاربردهای صنعتی و آزمایشگاهی حلالیت متانول
نوشته شده توسط شرکت صنایع متانول ایران
منتشر شده توسط شرکت صنایع متانول ایران
تاریخ انتشار مقاله : 27-09-1404
تاریخ بروزرسانی مقاله : 27-09-1404
تعداد کلمات : 3300
آدرس مقاله : لینک مقاله
قطبیت و حلالیت متانول در آب و حلال های آلی

مقدمه
متانول یک الکل ساده با فرمول شیمیایی CH3OH است که به خاطر قطبیت بالا و قابلیت اختلاط با بسیاری از مایعات شناخته می شود. یکی از مهم ترین ویژگی متانول توانایی آن در مخلوط شدن با آب و انواع حلال های آلی به خاطر ساختار مولکولی آن است. مولکول متانول از یک گروه متیل (CH3) متصل به یک گروه هیدروکسیل (OH) تشکیل شده است که به آن ماهیتی دوگانه می دهد. گروه هیدروکسیل قطبی متانول می تواند پیوند هیدروژنی تشکیل دهد، در حالی که گروه متیل کوچک و غیر قطبی آن ویژگی آب گریز خفیفی به مولکول می بخشد. در نتیجه متانول به عنوان پلی بین مواد قطبی و مواد غیر قطبی در بسیاری از سیستم های شیمیایی عمل می کند. همین ویژگی های فیزیکوشیمیایی سبب شده است که در کاربردهای صنعتی گسترده، به ویژه در فرآیندهای تولیدی و حلال سازی در مقیاس بالا، موضوع خرید متانول کاوه فله برای واحدهای صنعتی و شیمیایی اهمیت ویژه ای داشته باشد. در این مقاله بررسی می کنیم که چگونه قطبیت و برهم کنش های مولکولی حلالیت متانول در آب و حلال های آلی مختلف را کنترل می کنند و اصول کلیدی و کاربردهای عملی آن را مورد تاکید قرار می دهند.
متانول: ساختار شیمیایی و قطبیت
ساختار شیمیایی متانول به طور مستقیم بر قطبیت آن تاثیر می گذارد. متانول ساده ترین الکل است و از یک اتم کربن تشکیل شده که به سه اتم هیدروژن و یک گروه هیدروکسیل (CH3–OH) متصل شده است. اتم اکسیژن در این مولکول بسیار الکترونگاتیو است و چگالی الکترون را از پیوندهای C–O و O–H به سمت خود می کشد و یک گشتاور دوقطبی مشخص در مولکول ایجاد می کند. پیوند O–H در متانول قطبی است و توانایی تشکیل پیوند هیدروژنی دارد. متانول دارای گشتاور دوقطبی حدود 1.7 دبی و ثابت دی الکتریک تقریبا 33 در دمای اتاق است که نشان دهنده ماهیت شدیداً قطبی آن است. با این حال در مقایسه با آب (که ثابت دی الکتریک ~80 دارد)، قطبیت متانول کمتر است. گروه متیل منفرد آن نسبتا کوچک است اما مقداری خاصیت غیر قطبی به مولکول اضافه می کند. در مجموع ساختار مولکولی متانول باعث می شود این ماده یک مولکول به شدت قطبی (از نوع پروتیک) باشد که می تواند با دیگر مولکول های قطبی برهم کنش قوی داشته باشد، هرچند نسبت به آب خاصیت آب گریزی بیشتری دارد.
اصول قطبیت و حلالیت (شبیه شبیه را در خود حل می کند)
انحلال پذیری در سیستم های شیمیایی تا حد زیادی تابع اصل شبیه شبیه را در خود حل می کند است. معنای این اصل آن است که مواد قطبی تمایل دارند در حلال های قطبی خوب حل شوند و مواد غیر قطبی نیز در حلال های غیر قطبی حل می شوند. قطبیت به توزیع بار الکتریکی در سراسر یک مولکول اشاره دارد. مولکول های بسیار قطبی جدایش بار قابل توجهی دارند و از طریق نیروهای دوقطبی-دوقطبی یا پیوند هیدروژنی یکدیگر را جذب می کنند. متانول، چون قطبی است، به راحتی در حلال های قطبی حل می شود زیرا این برهم کنش های مطلوب بین آنها برقرار است. در مقابل، در محیط های غیر قطبی هیچ نیروی جاذبه قوی وجود ندارد که بتواند گروه های قطبی متانول را در خود جای دهد. مفهوم «شبیه، شبیه را حل می کند ریشه در ترمودینامیک دارد: زمانی که برهم کنش های میان ماده حل شونده و حلال از نظر ماهیت شبیه نیروهای بین مولکولی خود حلال باشند، اختلاط از نظر انرژی سودمند است. برای متانول، قطبیت و توانایی پیوند هیدروژنی آن به این معنی است که در آب و دیگر حلال های قطبی بسیار خوب حل می شود، اما در موادی که فاقد قطبیت هستند به خوبی حل نمی شود. درک این اصل مبنایی برای پیش بینی رفتار متانول در سیستم های حلال مختلف فراهم می کند.
متانول به عنوان یک حلال قطبی پروتیک
در دسته بندی های شیمیایی، متانول به عنوان یک حلال قطبی پروتیک شناخته می شود. قطبی پروتیک یعنی این که حلال قطبی بوده و یک اتم هیدروژن متصل به اتمی الکترونگاتیو (در اینجا اکسیژن) دارد که می تواند در پیوند هیدروژنی شرکت کند. این دسته شامل حلال هایی مانند آب، اتانول و اسید استیک است. ماهیت پروتیک متانول به آن امکان می دهد که هم نقش دهنده و هم پذیرنده پیوند هیدروژنی را ایفا کند. متانول به عنوان یک حلال می تواند یون ها و مولکول های قطبی را با احاطه کردن آنها و ایجاد برهم کنش های مطلوب پایدار کند. برای مثال، متانول می تواند کاتیون ها (یون های مثبت) را حلال پوشی کند، به این صورت که اتم اکسیژن خود (با بار منفی جزئی) را به سمت آنها قرار می دهد؛ و آنیون ها (یون های منفی) را نیز از طریق تشکیل پیوند هیدروژنی توسط هیدروژن گروه O–H خود حلال پوشی می کند. قطبیت متانول به حدی است که می تواند بسیاری از ترکیبات آلی را حل کند، به ویژه آن هایی که می توانند در پیوند هیدروژنی یا برهم کنش های دوقطبی وارد شوند. متانول همچنین وزن مولکولی نسبتا کمی و گرانروی پایینی دارد که به آن کمک می کند در مواد حل شونده به طور موثر نفوذ کرده و با آنها برهم کنش کند. شیمیدان ها غالبا از متانول به عنوان حلال در واکنش ها و کروماتوگرافی استفاده می کنند، زیرا دارای همین ویژگی های قطبی است. اما از آنجا که قطبیت آن از آب کمتر است, گاهی برخی مواد آلی معین را راحت تر از آب حل می کند که جایگاه منحصر به فرد آن را در طیف قطبیت نشان می دهد.
پیوند هیدروژنی بین متانول و آب
یکی از دلایل اصلی امتزاج کامل متانول و آب، پیوندهای هیدروژنی قوی بین مولکول های آنها است. آب مولکولی بسیار قطبی با دو پیوند O–H است که می تواند یک شبکه گسترده پیوند هیدروژنی تشکیل دهد. زمانی که متانول به آب افزوده می شود, گروه –OH آن می تواند با مولکول های آب پیوند هیدروژنی برقرار کند. متانول هم به عنوان دهنده پیوند هیدروژنی (از طریق هیدروژن گروه O–H خود) و هم پذیرنده (از طریق جفت الکترون های آزاد اکسیژن خود) عمل می کند. این بدین معنی است که هر مولکول متانول می تواند خود را در شبکه پیوند هیدروژنی آب جای دهد و برهم کنش های آب-آب را با برهم کنش های آب-متانول جایگزین کند. تشکیل این پیوندهای هیدروژنی انرژی آزاد می کند که به پیشرفت فرایند اختلاط کمک می کند. در واقع، مخلوط کردن متانول و آب یک اثر اندکی گرمازا (رهاسازی گرما) دارد که ناشی از تشکیل پیوندهای هیدروژنی است. از نظر ساختاری، متانول شبکه منظم آب را مختل می کند، اما چون همچنان می تواند پیوند هیدروژنی برقرار کند، این دو مایع به یک محلول یکنواخت دست می یابند. این برهم کنش هیدروژنی تضمین می کند که مولکول های متانول و آب در مقیاس مولکولی به طور کامل با هم آمیخته شوند هنگامی که با هم ترکیب می شوند.
متانول و آب: امتزاج پذیری کامل در همه نسبت ها
متانول و آب به طور کامل در هم مخلوط می شود. یعنی در هر نسبتی که این دو را ترکیب کنیم، نتیجه یک فاز مایع همگن خواهد بود و لایه های مجزا تشکیل نمی شود. این حلالیت متقابل نامحدود ناشی از قطبیت قابل مقایسه این دو و توانایی آنها در ایجاد برهم کنش های بین مولکولی قوی با یکدیگر است. هر دو مایع قطبی هستند و توانایی تشکیل پیوند هیدروژنی را دارند، بنابراین عملا هیچ مانعی برای اختلاط وجود ندارد. این در تضاد کامل با رفتار آب در برابر مایعات غیر قطبی (مانند روغن ها) است که در آنها لایه های مجزا تشکیل می شود. سامانه متانول-آب نشان می دهد زمانی که یک مولکول آلی با قطبیت متوسط با یک حلال معدنی بسیار قطبی روبرو می شود چه اتفاقی می افتد: آنها به آسانی مخلوط می شوند. یکی از پیامد های این امتزاج پذیری کامل آن است که جداسازی متانول از آب پس از اختلاط نیاز به روش های پرانرژی مانند تقطیر دارد، زیرا جداسازی مکانیکی ساده کارساز نیست. همچنین، مخلوط های متانول-آب خواص کمی متفاوت (مانند نقطه جوش یا چگالی) نسبت به هر یک از دو ماده خالص دارند، اما در همه حال یک فاز باقی می مانند. این ویژگی به طور گسترده در محیط های صنعتی و آزمایشگاهی که محلول های آبی متانول رایج هستند مورد استفاده قرار می گیرد و نشان می دهد که چگونه قطبیت نتایج حلالیت را تعیین می کند.
مقایسه قطبیت متانول و آب
اگرچه متانول و آب هر دو قطبی هستند و کاملا با هم مخلوط می شوند، اما تفاوت های مهمی در قطبیت آنها وجود دارد. آب به دلیل ساختار مولکولی خود از متانول قطبی تر است آب دارای دو پیوند O–H قطبی و شکل خمیده است که منجر به گشتاور دوقطبی کل بالاتر (حدود 1.85 دبی) و ثابت دی الکتریک بسیار بالاتر (~80) می شود. متانول، با داشتن یک پیوند O–H و نسبت بزرگتری از هیدروژن و کربن غیر قطبی, گشتاور دوقطبی اندکی کمتر (~1.7 دبی) و ثابت دی الکتریک پایین تری (~33) دارد. این ارقام نشان می دهند که مولکول های آب در مقایسه با متانول توانایی بیشتری در پایدارسازی بارها و حل شونده های قطبی دارند. از نظر عملی، این بدان معناست که برخی ترکیبات یونی یا مواد بسیار قطبی که به آسانی در آب حل می شوند ممکن است در متانول کمتر حل شوند. برای مثال, نمک های معدنی مانند کلرید سدیم که در آب بسیار محلول هستند، در متانول خالص انحلال پذیری بسیار کمی دارند زیرا قطبیت متانول برای غلبه کامل بر پیوند یونی کافی نیست. افزون بر این، شبکه گسترده پیوندهای هیدروژنی آب به آن کشش سطحی و نقطه جوش بالاتری نسبت به متانول می دهد. قطبیت کمتر متانول به آن اجازه می دهد با برخی حلال های آلی که آب قادر به اختلاط با آنها نیست مخلوط شود و این نشان می دهد که رفتار حلالیت آن حد واسط بین آب بسیار قطبی و هیدروکربن های غیر قطبی است.
حلالیت متانول در حلال های مختلف (قطبی و غیر قطبی)
سازگاری متانول با سایر حلال ها دامنه گسترده ای دارد و از مایعات قطبی تا هیدروکربن های غیر قطبی را در بر می گیرد. ماهیت قطبی آن به این معنی است که معمولا با دیگر حلال های آلی قطبی و حتی با برخی حلال های با قطبیت متوسط, کاملا امتزاج پذیر است. برای مثال، متانول در هر نسبتی با اتانول (که یک الکل دیگر است) و با استون (یک حلال قطبی آپروتیک) مخلوط می شود. همچنین می تواند به طور کامل با حلال هایی مانند دی اتیل اتر یا کلروفرم که قطبیت یا قطبش پذیری متوسطی دارند آمیخته شود. در مقابل، متانول با حلال های واقعا غیر قطبی مانند آلکان ها کاملا امتزاج پذیر نیست. وقتی متانول به یک مایع غیر قطبی مانند هگزان یا تولوئن اضافه می شود، تنها مقدار محدودی از آن حل خواهد شد؛ با افزایش مقدار متانول، بقیه آن به صورت لایه ای جدا از فاز اصلی در می آید. این وضعیت به این دلیل رخ می دهد که نیروهای پراکندگی (دیسپرسیون) حاکم در حلال های غیر قطبی نمی توانند ماهیت قطبی و هیدروژنی متانول را به خوبی پذیرش کنند. جدول زیر مقایسه ای از رفتار حلالیت متانول با چند حلال نمونه ارائه می دهد و نشان می دهد چگونه همخوانی قطبیت به امتزاج پذیری منجر می شود، در حالی که عدم تطابق قطبیت باعث تشکیل فازهای جداگانه می شود.
| حلال | نوع قطبیت | ثابت دی الکتریک (ε) | قابلیت اختلاط با متانول | توضیحات |
|---|---|---|---|---|
| آب | قطبی پروتیک | ~80 | کاملا قابل اختلاط | پیوند هیدروژنی گسترده امکان اختلاط کامل را فراهم می کند. |
| اتانول | قطبی پروتیک | ~24 | کاملا قابل اختلاط | ساختار الکلی قطبی مشابه، اختلاط را آسان می سازد. |
| استون | قطبی آپروتیک | ~21 | کاملا قابل اختلاط | برهم کنش دوقطبی - دوقطبی امکان حل شدن کامل را فراهم می کند. |
| دی اتیل اتر | کم قطبی | ~4.3 | کاملا قابل اختلاط | می تواند پیوند هیدروژنی را بپذیرد؛ علی رغم قطبیت کم مخلوط می شود. |
| کلروفرم | غیر قطبی | ~4.8 | کاملا قابل اختلاط | حلال قطبش پذیر؛ متانول در هر نسبتی با آن مخلوط می شود. |
| بنزن | غیر قطبی | ~2.3 | غیر قابل اختلاط (بسیار محدود) | اختلاف زیاد قطبیت باعث تشکیل فاز جداگانه می شود. |
| هگزان | غیر قطبی | ~1.9 | غیر قابل اختلاط (بسیار محدود) | بسیار غیر قطبی؛ متانول لایه مجزا تشکیل می دهد. |
ماهیت دوگانه قطبی و غیر قطبی مولکول متانول
متانول دارای ماهیتی دوگانه است، به این معنا که هم یک گروه عاملی قطبی و هم یک بخش کوچک غیر قطبی در ساختار خود دارد. این ترکیب منحصر به فرد به متانول امکان می دهد با طیف گسترده ای از مواد تعامل داشته باشد. بخش هیدروکسیل (-OH) آن به شدت آب دوست است و به راحتی در پیوند هیدروژنی و برهم کنش های دوقطبی شرکت می کند. از سوی دیگر گروه متیل (CH3) آن آب گریز است، هرچند اندازه بسیار کوچکی دارد. ماهیت دوگانه متانول به آن اجازه می دهند که برخی ترکیباتی را حل کند که آب خالص (فاقد هر بخش غیر قطبی) نمی تواند حل کند. برای مثال، متانول می تواند برخی مولکول های آلی را که عمدتا ساختار غیر قطبی دارند اما یک گروه قطبی در خود جای داده اند بهتر حل کند، در حالی که آب ممکن است آنها را به خوبی حل نکند. جزء غیر قطبی متانول، با وجود کوچک بودن، قطبیت کلی آن را نسبت به آب کاهش می دهد و متانول را به حلالی همه کاره تر برای مواد قطبی و تا حدی غیر قطبی تبدیل می کند. به زبان عملی، متانول می تواند نقش نوعی واسطه را ایفا کند: با آب امتزاج پذیر است و همچنین با بسیاری از حلال های آلی مخلوط می شود و بنابراین اغلب برای ایجاد مخلوط های تک فاز از مایعاتی که در حالت عادی با هم ناسازگارند استفاده می شود. این ویژگی آمفی فیلیک (هرچند به اندازه الکل های بزرگتر یا سورفکتانت ها بارز نیست) کلید مفید بودن متانول به عنوان یک حلال در شیمی و صنعت است.
تاثیر دما بر حلالیت متانول
دما می تواند بر حلالیت و امتزاج پذیری متانول با سایر مایعات تاثیر بگذارد. به طور کلی، افزایش دما تمایل دارد حلالیت مایعات در یکدیگر را بهبود بخشد. در مواردی که متانول و یک حلال دیگر در دمای اتاق تنها تا حدی با هم امتزاج پذیر هستند، دماهای بالاتر اغلب دامنه حلالیت متقابل آنها را گسترش می دهد. برای مثال، متانول و هگزان که در شرایط محیطی فراتر از نسبت های معینی لایه های جداگانه تشکیل می دهند، در دماهای بالاتر بالای حدود 30–50 °C کاملا امتزاج پذیر می شوند. حرارت انرژی جنبشی مولکولی لازم برای غلبه بر بخشی از عدم امتزاج ناشی از تفاوت های قطبیت را فراهم می کند و به مولکول ها اجازه می دهد آزادانه تر با هم بیامیزند. برعکس، سرد کردن یک مخلوط می تواند حلالیت را کاهش دهد؛ یک محلول یکنواخت متانول-آلی در دمای اتاق ممکن است در صورت سرد شدن کافی به دو فاز جداگانه تقسیم شود، زیرا انرژی حرارتی کمتر دیگر نمی تواند تفاوت نیروهای بین مولکولی را جبران کند. علاوه بر رفتار فازی، دما بر سرعت حل شدن مواد در متانول و ظرفیت آن برای نگه داشتن حل شونده ها نیز تاثیر می گذارد. در نظر گرفتن دما هنگام استفاده از متانول در فرایند هایی مانند استخراج یا تبلور مجدد مهم است، زیرا قدرت حلال متانول برای حل شونده های جامد و حلال های همراه می تواند با دما تغییر کند و گاهی با سرد شدن موجب رسوب یا لایه لایه شدن شود.
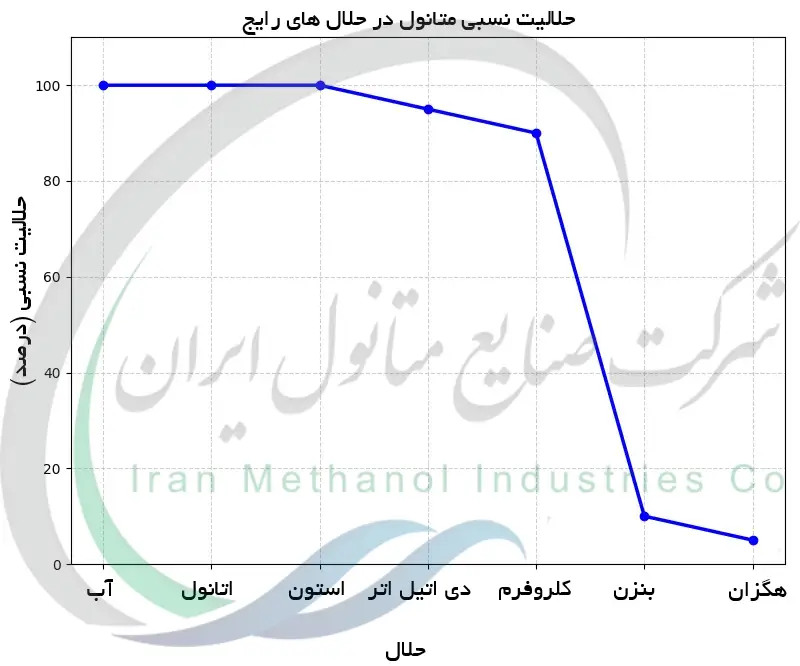
شاخص قطبیت و ثابت دی الکتریک متانول
شیمیدان ها از معیارهای کمی برای بیان قطبیت حلال ها استفاده می کنند و متانول در این مقیاس ها امتیاز بالایی دارد. یکی از معیارهای رایج ثابت دی الکتریک (ε) است که برای متانول در حدود 32.6 در 20 درجه سانتی گراد می باشد. این مقدار بالا نشان دهنده توانایی زیاد در پایدارسازی بارها است (برای مقایسه، ثابت دی الکتریک آب ~80، اتانول ~24 و هگزان ~1.9 است). معیار رایج دیگر شاخص قطبیت حلال است که در آن برای متانول عدد حدود 5.1 در نظر گرفته شده (در مقیاسی که آب 10.2 و هگزان 0.0 است). این اعداد متانول را در زمره حلال های آلی نسبتا قطبی قرار می دهد. همچنین، گشتاور دوقطبی ~1.7 دبی متانول قطبیت مولکولی آن را نشان می دهد. ثابت دی الکتریک بالای متانول توضیح می دهد که چرا این حلال ترکیبات یونی و قطبی را بسیار بهتر از حلال هایی با ثابت دی الکتریک کمتر حل می کند. در مقابل، شاخص قطبیت (که اغلب در کروماتوگرافی استفاده می شود) توانایی متانول در شویش ترکیبات قطبی نسبت به حلال های دیگر را نشان می دهد. در مفاهیم کروماتوگرافی، متانول به عنوان یک حلال واجد قدرت شویندگی بیشتر نسبت به حلال های کم قطبیت مثل دی کلرومتان یا هگزان عمل می کند. در مجموع شاخص های قطبیت متانول به طور کمی آنچه را که به طور کیفی مشاهده می شود تایید می کنند: متانول به طور قابل توجهی قطبی است، گرچه نه به شدت آب، و آن را به حلالی عالی برای بسیاری از مواد قطبی و اندکی غیر قطبی تبدیل کرده است.
متانول در مقایسه با الکل های بالاتر: روند حلالیت در آب
مقایسه متانول با سایر الکل ها روندی را در حلالیت آنها در آب نشان می دهد که به اندازه مولکولی و قطبیت مربوط است. متانول (CH3OH) و اتانول (C2H5OH) هر دو به طور کامل در آب امتزاج پذیر هستند. با افزایش طول زنجیر آلکیل در الکل ها (پروپانول، بوتانول و غیره)، قطبیت کلی مولکول کاهش می یابد زیرا بخش هیدروکربنی مولکول آب گریز بوده و تاثیر آن بیشتر می شود. 1-پروپانول (C3H7OH) هنوز با آب امتزاج پذیر است، اما در آستانه قرار دارد؛ وقتی به 1-بوتانول (C4H9OH) می رسیم، آب و بوتانول دیگر کاملا امتزاج پذیر نیستند بوتانول در دمای اتاق تنها حدود 7–8 گرم در 100 میلی لیتر آب حل می شود و پس از آن جدایش فازی رخ می دهد. این به این دلیل است که بخش غیر قطبی بزرگتر در بوتانول اثر گروه قطبی –OH را تحت الشعاع قرار می دهد و باعث می شود مولکول بیشتر شبیه یک روغن رفتار کند. متانول که کوچکترین گروه آلکیل ممکن را دارد، قطبی ترین الکل در این سری است (به جز اتیلن گلیکول یا سایر پلی ال ها) و بنابراین قابلیت حل شدن کامل در آب را حفظ می کند. این روند نشان می دهد که چگونه افزودن کربن ها (افزایش خاصیت آب گریزی) حلالیت یک الکل در آب را به طور سیستماتیک کاهش می دهد. قرارگیری متانول در انتهای طیف الکل های ساده از نظر قطبیت پشتوانه امتزاج پذیری استثنایی آن با آب و توصیف آن به عنوان یک حلال آب دوست است.
کاربردهای صنعتی و آزمایشگاهی حلالیت متانول
ویژگی های قطبیت و حلالیت متانول باعث شده است که در محیط های صنعتی و آزمایشگاهی بسیار مفید باشد. یک کاربرد رایج آن استفاده به عنوان حلال یا جزء ضدیخ در محلول های شیشه شوی خودرو و محلول های یخ زدا است که در آنها متانول با آب مخلوط می شود تا نقطه انجماد را کاهش دهد؛ این امر به این دلیل موثر است که متانول با آب کاملا امتزاج پذیر است. در صنایع شیمیایی، متانول اغلب به عنوان حلال برای واکنش ها و استخراج ها استفاده می شود توانایی آن در حل کردن طیف وسیعی از مواد آلی و معدنی به پیشبرد فرایندهای شیمیایی کمک می کند. این ویژگی به ویژه در مسیرهای سنتزی و واکنشی اهمیت دارد، زیرا واکنش های اکسیداسیون متانول به شدت به محیط حلال و میزان امتزاج پذیری آن با آب یا سایر اجزا وابسته هستند. برای مثال در تولید بیودیزل از متانول برای ترانس استریفیکاسیون روغن ها استفاده می شود (اگرچه متانول به تنهایی با روغن ها خوب مخلوط نمی شود، حضور کاتالیزور و شرایط واکنش الکلیز موجب تشکیل یک فاز واحد برای واکنش می شود). در آزمایشگاه ها، متانول به عنوان حلال برای آماده سازی نمونه و در کروماتوگرافی مانند HPLC استفاده می شود، زیرا قطبیت متوسط آن می تواند ترکیبات قطبی را به طور موثر شویش کند و به راحتی با آب یا حلال های دیگر ترکیب می شود تا شیب های حلال ساخته شوند. همچنین در رسوب دهی بیومولکول ها کاربرد دارد: افزودن متانول به محلول های آبی DNA یا پروتئین ها می تواند باعث رسوب آنها شود، زیرا متانول توان آب در حلال پوشی این مولکول ها را تضعیف می کند. قطبیت متانول آن را همه کاره می کنند به عنوان مثال از آن به عنوان پاک کننده برای برخی تجهیزات الکترونیکی و ابزار آزمایشگاهی استفاده می شود زیرا می تواند آلاینده های قطبی را حل کند و سپس به سرعت تبخیر شود. از افزودنی های سوخت گرفته تا تولید پلیمر، ویژگی های حلالیت متانول نقش اساسی در کارکرد آن در کاربردهای مختلف ایفا می کند.




